题目内容
20.图分别表示红磷、白磷燃烧时的能量变化,下列说法中正确的是( )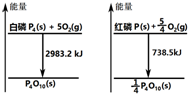
| A. | 白磷比红磷稳定 | |
| B. | 白磷燃烧产物比红磷燃烧产物稳定 | |
| C. | 1mol白磷转变为红磷放出2244.7kJ的热量 | |
| D. | 红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ |
分析 由图:①$\frac{1}{4}$P4(s,白磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H=-745.8kJ/mol;
②P(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol; 通过两个热化学方程式分析,等质量的白磷和红磷完全燃烧时释放的能量白磷比红磷多,白磷能量比红磷高,红磷更稳定,据此分析.
解答 解:A、等质量的白磷和红磷完全燃烧时释放的能量白磷比红磷多,白磷能量高于红磷,所以红磷稳定,故A错误;
B、两者燃烧产物相同状态相同,所以产物稳定相同,故B错误;
C、红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ•mol-1;P4O10(s)=4P(s、红磷)+5O2(g);△H=738.5×4kJ•mol-1=2954kJ•mol-1;
根据盖斯定律,白磷转化为红磷的热化学方程式:
P4(s、白磷)=4P(s、红磷)△H=-2983.2kJ/mol+2954kJ•mol-1=-29.2KJ/mol,
即为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol,所以1mol白磷转变为红磷放出29.2KJ的热量,故C错误;
D、依据图象分析,红磷燃烧是放热反应,红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+738.5kJ×4=2954 kJ,故D正确;
故选D.
点评 本题考查了反应焓变与物质能量的关系分析,图象分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
10.化学反应可以从不同的角度进行分析,以下观点中正确的是( )
| A. | 放热反应在常温下均能自发进行 | |
| B. | 原电池工作时所发生的反应一定有氧化还原反应 | |
| C. | 加热时,化学反应只向吸热反应方向进行 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写无关 |
11.下列实验方案中,不能 达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证盐类的水解是否是吸热反应 | 向醋酸钠溶液中滴入酚酞试液,加热观察红色是否加深 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
8.1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 该浓硝酸中HNO3的物质的量浓度是12.0 mol/L | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是20% | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL |
15.下列化学用语正确的是( )
| A. | 氯化氢的比例模型: | B. | Cl-的结构示意图: | ||
| C. | 氯乙烯的结构简式:CH2=CHCl | D. | HClO的电子式: |
5. 倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
 倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )| A. | 水是钠与硫反应的催化剂 | B. | 酚酞的水溶液变红色 | ||
| C. | 钠与硫的反应是放热反应 | D. | 滤纸逐渐变黑 |
9.下列各组离子,能在溶液中大量共存的是( )
| A. | Ca2+、Mg2+、Cl-、NO3- | B. | Al3+、K+、SO42-、OH- | ||
| C. | Fe2+、H+、SO42-、NO3- | D. | Na+、OH-、HCO3-、SO42- |
10.乙二酸(COOH-COOH)与丁醇(C4H10O)在一定条件下反应,生成的二酯有( )
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |