题目内容
12.二氧化氯(ClO2)是高效、低毒的消毒剂,在自来水消毒和果蔬保鲜等方面应用广泛.但ClO2的稳定性差,所以将ClO2用稳定剂吸收,使用时加酸释放出ClO2.实验室用NaClO3与Na2SO3在H2SO4存在下反应,水浴80℃制得ClO2,实验装置如图1:完成下列填空:
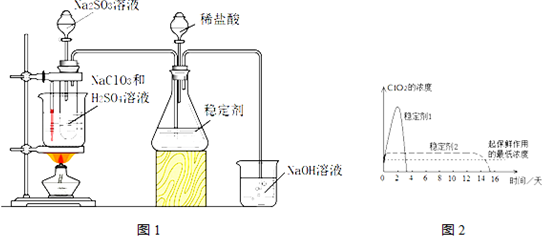
(1)写出制备ClO2的化学方程式2NaClO3+Na2SO3+H2SO4→2ClO2+2Na2SO4+H2O.
(2)使用热水浴的优点是受热均匀,易控温;如果滴加Na2SO3溶液的速度过快,可能造成的后果是稳定剂来不及充分吸收ClO2.
(3)图2是两种稳定剂加酸后释放ClO2的浓度随时间的变化图,若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂2,原因是稳定剂2可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐,若要除去超标的亚氯酸盐,下列物质最适宜的是d
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
(5)某同学在实验室测定某消毒剂中ClO2的含量,其实验操作如下:
Ⅰ.在锥形瓶中加入足量的KI溶液,再加入3mL稀硫酸
Ⅱ.取10mL消毒剂于锥形瓶中,ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+→2Cl-+5I2+4H2O
Ⅲ.用0.100mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-→2I-+S4O62-),淀粉作指示剂,达到滴定终点时用去20.00mL Na2S2O3标准溶液.滴定至终点的现象是蓝色消失,且半分钟内不恢复,测得该消毒剂中ClO2的含量为2.7 g/L.
分析 (1)用NaClO3与Na2SO3在H2SO4存在下反应,水浴80℃制得ClO2,根据元素守恒可写出化学方程式;
(2)使用热水浴加热,使试管受热均匀且易控制温度;如果滴加Na2SO3溶液的速度过快,则产生的ClO2的速率较快,稳定剂可能来不及充分吸收ClO2;
(3)由图可知,稳定剂2可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度;
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子;
(5)用Na2S2O3标准溶液滴定碘单质,淀粉作指示剂,达到滴定终点时溶液蓝色褪去,根据反应2ClO2+10I-+8H+→2Cl-+5I2+4H2O及I2+2S2O32-→2I-+S4O62-,可得关系式ClO2~5S2O32-,实验中用去 Na2S2O3的物质的量为0.100mol/L×0.02L=0.002 mol,所以10mL消毒剂中含有的物质的量为0.002 mol÷5=0.0004mol,据此确定消毒剂中ClO2的含量;
解答 解:(1)用NaClO3与Na2SO3在H2SO4存在下反应,水浴80℃制得ClO2,反应的化学方程式为2NaClO3+Na2SO3+H2SO4→2ClO2+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4→2ClO2+2Na2SO4+H2O;
(2)使用热水浴加热,使试管受热均匀且易控制温度;如果滴加Na2SO3溶液的速度过快,则产生的ClO2的速率较快,稳定剂可能来不及充分吸收ClO2,
故答案为:受热均匀,易控温;稳定剂来不及充分吸收ClO2;
(3)由图可知,稳定剂2可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂2好,
故答案为:稳定剂2;稳定剂2可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度;
(4)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,
故答案为:d;
(5)用Na2S2O3标准溶液滴定碘单质,淀粉作指示剂,达到滴定终点时溶液蓝色消失,且半分钟内不恢复,根据反应2ClO2+10I-+8H+→2Cl-+5I2+4H2O及I2+2S2O32-→2I-+S4O62-,可得关系式ClO2~5S2O32-,实验中用去 Na2S2O3的物质的量为0.100mol/L×0.02L=0.002 mol,所以10mL消毒剂中含有的物质的量为0.002 mol÷5=0.0004mol,所以消毒剂中ClO2的含量为$\frac{0.0004×67.5g}{0.01L}$=2.7g/L,
故答案为:蓝色消失,且半分钟内不恢复;2.7.
点评 本题以ClO2的制备、吸收、释放为载体考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 食盐 | B. | 淀粉酶 | C. | 蛋白酶 | D. | 酒精 |
| 选项 | 纯净物 | 酸性氧化物 | 碱性氧化物 | 酸 | 盐 |
| A | 碱石灰 | 二氧化硫 | 氧化铝 | 乙二酸 | 小苏打 |
| B | 五水硫酸铜 | 三氧化硫 | 氧化铜 | 油酸 | 苏打 |
| C | 过氧化氢 | 五氧化二磷 | 过氧化物 | 硬脂酸 | 碱式碳酸铜 |
| D | 盐酸 | 一氧化碳 | 氧化镁 | 冰醋酸 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
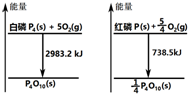
| A. | 白磷比红磷稳定 | |
| B. | 白磷燃烧产物比红磷燃烧产物稳定 | |
| C. | 1mol白磷转变为红磷放出2244.7kJ的热量 | |
| D. | 红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ |
| HF | HClO | H2S | C6H5OH |
| Ki=3.53×l0-4 | Ki=2.95×l0-8 | K1=9.1×l0-8 K2=1.1×l0-12 | Ki=1.28×l0-10 |
| A. | ClO-+H2S→HClO+HS- | B. | H2S+2C6H5O-→2C6H5OH+S2- | ||
| C. | HF+C6H5O-→C6H5OH+F- | D. | HF(少量)+S2-→F-+HS- |
| A. |  天然气 天然气 | B. |  汽油 汽油 | C. |  浓硫酸 浓硫酸 | D. |  高锰酸钾 高锰酸钾 |
| A. | 胶体的本质特征为均匀稳定 | |
| B. | 胶体和溶液可以通过丁达尔效应来鉴别 | |
| C. | 可以用饱和氯化铁溶液和氢氧化钠溶液混合来制取氢氧化铁胶体 | |
| D. | 可以用过滤的方法净化胶体 |
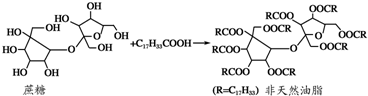
| A. | 该非天然油脂结构中含有2种官能团 | |
| B. | 油酸与蔗糖发生的反应类型属于取代反应 | |
| C. | 该非天然油脂能与氢氧化钠溶液、溴的四氯化碳溶液发生反应 | |
| D. | 蔗糖分子可以看作是两个不同的单糖分子间脱去一个水分子形成的 |