题目内容
V、W、X、Y、Z是原子序数依次增大的前四周期元素,其相关信息如下表
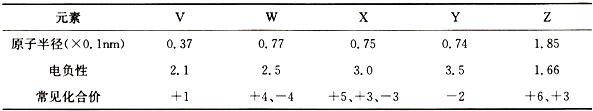
(1)Z元素是人和动物所必需的一种微量元素,Z的电子层数和W的最外层电子数相等,Z的核电荷数是Y的核电荷数3倍,Z位于元素周期表第 周期第 族,Z的基态原子核外电子排布式是 .
(2)Y与W、X的第一电离能由大到小的顺序为 (用元素符号表示).常温下液态V2Y中除了简单V2Y分子外,因为 的存在,还有(V2Y)2,(V2 Y)3,…(V2Y)n等缔合分子存在.温度降至熔点时,V2Y结成巨大的缔合物晶体,该晶体类型为 .
(3)已知X3-和WY2间具有相似的化学键特征和相似的化学结构,则X3-中含有的π键数目为 .在水溶液中X2H5+将Fe3+还原为Fe2+,X2H5++4Fe3+→4Fe2++…其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为 .
(4)发射卫星时常用X2V4为燃料,目前科学家尝试用周期表中电负性最强元素R的单质作氧化剂,反应释放能量会更大.若已知16g的液态X2V4在气态R单质中完全燃烧生成X的单质和一种气态化合物后恢复至原状态,放热567.5KJ,该反应的热化学方程式为 .

(1)Z元素是人和动物所必需的一种微量元素,Z的电子层数和W的最外层电子数相等,Z的核电荷数是Y的核电荷数3倍,Z位于元素周期表第
(2)Y与W、X的第一电离能由大到小的顺序为
(3)已知X3-和WY2间具有相似的化学键特征和相似的化学结构,则X3-中含有的π键数目为
(4)发射卫星时常用X2V4为燃料,目前科学家尝试用周期表中电负性最强元素R的单质作氧化剂,反应释放能量会更大.若已知16g的液态X2V4在气态R单质中完全燃烧生成X的单质和一种气态化合物后恢复至原状态,放热567.5KJ,该反应的热化学方程式为
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用,热化学方程式
专题:基本概念与基本理论
分析:V、W、X、Y、Z是原子序数依次增大的前四周期元素,Y只有-2价,则Y为O元素,X的化合价为+5,+3,-3,而且原子半径比O稍大,则X为N元素,W为-4、+4价,而且半径比N稍大,则W为C元素,V为+1价,半径比O的半径小,则V为H元素,Z元素是人和动物所必需的一种微量元素,Z的电子层数和W的最外层电子数相等,Z的核电荷数是Y的核电荷数3倍,则Z为的核电荷数为24,Z为Cr元素,据此分析.
解答:
解:V、W、X、Y、Z是原子序数依次增大的前四周期元素,Y只有-2价,则Y为O元素,X的化合价为+5,+3,-3,而且原子半径比O稍大,则X为N元素,W为-4、+4价,而且半径比N稍大,则W为C元素,V为+1价,半径比O的半径小,则V为H元素,Z元素是人和动物所必需的一种微量元素,Z的电子层数和W的最外层电子数相等,Z的核电荷数是Y的核电荷数3倍,则Z为的核电荷数为24,Z为Cr元素,
(1)Z为Cr元素,位于元素周期表第四周期第VIB族,Cr元素原子核外有24个电子,其基态原子核外电子排布式是1s22s22p63s23p63d54s1;
故答案为:四;VIB;1s22s22p63s23p63d54s1;
(2)同周期从左到右第一电离能依次增大,但是第IIA和第IIIA族,第VA族和第VIA族反常,则第一电离能由大到小的顺序为N>O>C;常温下液态H2O中除了简单H2O分子外,因为氢键的存在,还有(H2O)2,(H2O)3,…(H2O)n等缔合分子存在,水分子对应的晶体为分子晶体;
故答案为:N>O>C;氢键;分子晶体;
(3)N-3和CO2具有相似的化学键特征和相似的化学结构,已知氮气的结构为N≡N,氮气中含有2个π键,则N-3中含有的π键数目为2;在水溶液中N2H+5将Fe3+还原为Fe2+,氮元素被氧化为N2,则反应的离子方程式为:N2H+5+4Fe3+=4Fe2++N2+5H+;
故答案为:2;N2H+5+4Fe3+=4Fe2++N2+5H+;
(4)发射卫星时常用N2H4为燃料,目前科学家尝试用周期表中电负性最强元素F的单质F2作氧化剂,反应释放能量会更大,若已知16g的液态N2H4在气态F2中完全燃烧生成N2和HF,放热567.5KJ,则1molN2H4 (l)完全反应放热为1135.0 kJ/mol,则反应的热化学方程式为:N2H4 (l)+2F2 (g)=N2 (g)+4HF (g)△H=-1135.0 kJ/mol;
故答案为:N2H4 (l)+2F2 (g)=N2 (g)+4HF (g)△H=-1135.0 kJ/mol.
(1)Z为Cr元素,位于元素周期表第四周期第VIB族,Cr元素原子核外有24个电子,其基态原子核外电子排布式是1s22s22p63s23p63d54s1;
故答案为:四;VIB;1s22s22p63s23p63d54s1;
(2)同周期从左到右第一电离能依次增大,但是第IIA和第IIIA族,第VA族和第VIA族反常,则第一电离能由大到小的顺序为N>O>C;常温下液态H2O中除了简单H2O分子外,因为氢键的存在,还有(H2O)2,(H2O)3,…(H2O)n等缔合分子存在,水分子对应的晶体为分子晶体;
故答案为:N>O>C;氢键;分子晶体;
(3)N-3和CO2具有相似的化学键特征和相似的化学结构,已知氮气的结构为N≡N,氮气中含有2个π键,则N-3中含有的π键数目为2;在水溶液中N2H+5将Fe3+还原为Fe2+,氮元素被氧化为N2,则反应的离子方程式为:N2H+5+4Fe3+=4Fe2++N2+5H+;
故答案为:2;N2H+5+4Fe3+=4Fe2++N2+5H+;
(4)发射卫星时常用N2H4为燃料,目前科学家尝试用周期表中电负性最强元素F的单质F2作氧化剂,反应释放能量会更大,若已知16g的液态N2H4在气态F2中完全燃烧生成N2和HF,放热567.5KJ,则1molN2H4 (l)完全反应放热为1135.0 kJ/mol,则反应的热化学方程式为:N2H4 (l)+2F2 (g)=N2 (g)+4HF (g)△H=-1135.0 kJ/mol;
故答案为:N2H4 (l)+2F2 (g)=N2 (g)+4HF (g)△H=-1135.0 kJ/mol.
点评:本题考查了位置结构与性质的关系,侧重于原子结构、元素周期表、电子排布式、氢键、热化学方程式等知识点的考查,明确原子半径、化合价与元素在周期表中的位置的关系是解题的关键,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
| A、物质的量为1:1 |
| B、体积比为11:7 |
| C、原子数比为1:1 |
| D、密度比为11:7 |
下列离子的检验正确的是( )
| A、某溶液中滴入盐酸,生成无色气体,说明原溶液中一定有CO32- |
| B、某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中一定有Cu2+ |
| C、某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中一定有SO42- |
| D、某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中一定有Cl- |
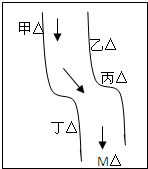 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断: