题目内容
等质量的Na2CO3和NaHCO3与足量的盐酸反应,消耗盐酸的物质的量之比为 ,生成CO2的物质的量之比为 .
考点:化学方程式的有关计算
专题:
分析:依据题意设出碳酸钠和碳酸氢钠的质量为m,则依据n=
分别计算两者的物质的量,然后计算生成二氧化碳的物质的量之比即可.
| m |
| M |
解答:
解:设碳酸钠和碳酸氢钠的质量为m,M(Na2CO3)=106g/mol,故n(Na2CO3)=
,M(NaHCO3)=78g/mol,故n(NaHCO3)=
,依据反应
Na2CO3+2HCl=2NaCl+CO2↑+H2O NaHCO3+HCl=NaCl+CO2↑+H2O
1 2 1 1 1 1
n1 x1
n2 x2
故n1:n2=2×
:
=78:53;
x1:x2=
:
=39:53,故答案为:78:53;39:53.
| m |
| 106g/mol |
| m |
| 78g/mol |
Na2CO3+2HCl=2NaCl+CO2↑+H2O NaHCO3+HCl=NaCl+CO2↑+H2O
1 2 1 1 1 1
| m |
| 106 |
| m |
| 78 |
故n1:n2=2×
| m |
| 106 |
| m |
| 78 |
x1:x2=
| m |
| 106 |
| m |
| 78 |
点评:本题主要考查的是碳酸钠与碳酸氢钠的性质以及有关化学反应方程式的计算,属于常考题.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列仪器中不能用于加热的是( )
| A、试管 | B、烧杯 | C、容量瓶 | D、坩埚 |
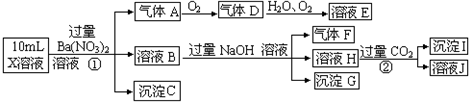
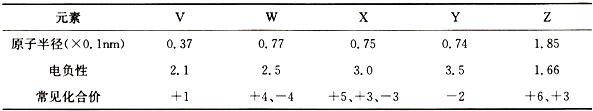
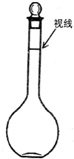 实验室要配制500mL 0.2mol/L NaOH溶液,请回答下列问题:
实验室要配制500mL 0.2mol/L NaOH溶液,请回答下列问题: