题目内容
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为c(Na+):c(Mg2+):c(Cl-)=3:4:5,若Na+的物质的量浓度为3mol?L-1,则SO42-的物质的量浓度为( )
| A、2 mol?L-1 |
| B、3 mol?L-1 |
| C、4 mol?L-1 |
| D、8 mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:根据钠离子的浓度,由离子浓度比例关系计算镁离子、氯离子的浓度,溶液呈电中性,根据溶液电荷守恒有c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),据此计算.
解答:
解:Na+浓度为3mol/L,由c(Na+):c(Mg2+):c(Cl-)=3:4:5,可得c(Mg2+)=4mol/L,c(Cl-)=5mol/L,
根据溶液电荷守恒有:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则:3mol/L+2×4mol/L=5mol/L+2c(SO42-)
解得:c(SO42-)=3mol/L,
故选B.
根据溶液电荷守恒有:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则:3mol/L+2×4mol/L=5mol/L+2c(SO42-)
解得:c(SO42-)=3mol/L,
故选B.
点评:本题考查物质的量浓度的有关计算,难度中等,注意电解质混合溶液中经常利用电荷守恒计算离子浓度.

练习册系列答案
相关题目
一定条件下存在反应:2SO2(g)+O2(g)═2SO3(g),△H<0.现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )


| A、容器I、Ⅲ中平衡常数相同 |
| B、容器II、Ⅲ中正反应速率始终相同 |
| C、容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D、容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和等于1 |
下列关于化学键的说法中正确的是( )
| A、气体单质中一定含有共价键 |
| B、由非金属元素组成的化合物一定是共价化合物 |
| C、含有离子键的晶体一定是离子晶体 |
| D、一定是在发生化学反应时,化学键才发生断裂 |
下列有关物质性质说法不正确的是( )
| A、热稳定性:HCl>HI |
| B、原子半径:Na>K |
| C、元素的最高正价:S>Si |
| D、氧化性:Br2<Cl2 |
下列有关物质的表达式不正确的是( )
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、(羟基)的电子式为: |
对于某些离子的检验及结论一定正确的是( )
| A、往溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中一定含有NH4+ |
| B、往溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则该溶液中一定含有Ba2+ |
| C、用铂丝蘸取溶液放在酒精灯上灼烧,观察火焰为黄色,则该溶液中一定含Na+而不含K+ |
| D、往溶液中加入少量氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定含有SO42- |
下列说法正确的是( )
| A、摩尔是七个基本物理量之一 |
| B、氮气的摩尔质量是28g |
| C、0.5mol氢气的体积为11.2L |
| D、1molH2O约含有6.02×1023个水分子 |
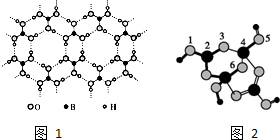 硼酸晶体具有层状结构,每一层的结构结构如图1所示.
硼酸晶体具有层状结构,每一层的结构结构如图1所示.