题目内容
 硼酸晶体具有层状结构,每一层的结构结构如图1所示.
硼酸晶体具有层状结构,每一层的结构结构如图1所示.(1)硼酸晶体属于
(2)硼酸晶体中,B的杂化轨道类型是
(3)硼酸晶体内所含有作用力类型有
(4)硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中C(H+)>c(OH-),Y-离子中的配位键可以表示为
(5)硼酸与氢氧化钠反应后,将溶液蒸发结晶,可以得到硼砂.硼砂阴离子Xm-(含B、O、H三种元素)的球棍模型如图2所示:
①Xm-的化学式为
②Xm-离子内部
考点:原子轨道杂化方式及杂化类型判断,配合物的成键情况,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)硼酸为白色结晶性粉末,分子式为:H3BO3;
(2)sp2杂化轨道由1个ns轨道和2个np轨道组合而形成,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分;
(3)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用,硼酸晶体内共价健、氢键、范德华力;
(4)硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,氧元素提供孤对电子给硼元素O→B;
(5)1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断Xm-的化学式;
(2)sp2杂化轨道由1个ns轨道和2个np轨道组合而形成,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分;
(3)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用,硼酸晶体内共价健、氢键、范德华力;
(4)硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,氧元素提供孤对电子给硼元素O→B;
(5)1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断Xm-的化学式;
解答:
解:(l)硼酸晶体中存在H3BO3分子,因此,是分子晶体,
故答案为:分子;
(2)在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与3个羟基相连,无孤对电子对,
故答案为:sp2杂化;
(3)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力,
故答案为:共价健、氢键、范德华力;
(4)硼酸中B原子属于缺电子原子,在水溶液中可以结合水电离出的氢氧根,硼酸与水作用,B(OH)3+H20?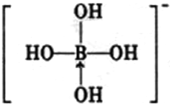 +H+,Y-离子中的配位键可以表示为
+H+,Y-离子中的配位键可以表示为 ,氧元素提供孤对电子给硼元素O→B,
,氧元素提供孤对电子给硼元素O→B,
故答案为: ;
;
(5))①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,所以Xm-的化学式为(B4O9H4)2-,
故答案为:(B4O9H4)2-;
②B原子最外层只有三个价电子,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,
故答案为:有;B原子最外层只有三个价电子,但是4号B原子形成了4个键;
故答案为:分子;
(2)在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与3个羟基相连,无孤对电子对,
故答案为:sp2杂化;
(3)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力,
故答案为:共价健、氢键、范德华力;
(4)硼酸中B原子属于缺电子原子,在水溶液中可以结合水电离出的氢氧根,硼酸与水作用,B(OH)3+H20?
 +H+,Y-离子中的配位键可以表示为
+H+,Y-离子中的配位键可以表示为 ,氧元素提供孤对电子给硼元素O→B,
,氧元素提供孤对电子给硼元素O→B,故答案为:
 ;
;(5))①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,所以Xm-的化学式为(B4O9H4)2-,
故答案为:(B4O9H4)2-;
②B原子最外层只有三个价电子,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,
故答案为:有;B原子最外层只有三个价电子,但是4号B原子形成了4个键;
点评:本题考查了晶体类型的判断、影响分子稳定性的因素、原子的杂化方式等知识点,题目难度较大,综合性强,注意分子的稳定性与化学键有关,物质的熔沸点与氢键有关.注意掌握杂化的理论应用.

练习册系列答案
相关题目
有下列试剂 ①KSCN ②淀粉-碘化钾溶液 ③Fe ④Cu ⑤H2S ⑥NH3?H2O ⑦Na2CO3溶液,和三氯化铁溶液反应时,使Fe 3+表现出氧化性的试剂有( )
| A、①⑥⑦ | B、②③④⑤ |
| C、④⑤⑥⑦ | D、全部 |
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为c(Na+):c(Mg2+):c(Cl-)=3:4:5,若Na+的物质的量浓度为3mol?L-1,则SO42-的物质的量浓度为( )
| A、2 mol?L-1 |
| B、3 mol?L-1 |
| C、4 mol?L-1 |
| D、8 mol?L-1 |
NA代表阿伏伽德罗常数的值,则以下说法正确的是( )
| A、1molFeCl3完全水解生成Fe(OH)3胶体,其中Fe(OH)3胶粒的个数为NA个 |
| B、25℃时,1L纯水中的H+数目约为10-14NA个 |
| C、1mol/L的盐酸溶液中Cl-的个数为NA个 |
| D、1L 1mol/L的Na2CO3溶液中所含阴离子的总数目大于NA个 |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
常温下,下列溶液中的粒子浓度关系正确的是( )
| A、NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B、Na2SO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) |
| C、NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D、浓度均为0.1mol?L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH) |
氢氟酸是一种弱酸,具有强烈的腐蚀性.常温下,在氢氟酸加水稀释的过程中
的变化趋势是( )
| c(H+) |
| c(F-) |
| A、变大 | B、变小 |
| C、不变 | D、无法确定 |