题目内容
15.已知:CO2(g)+C(s)═2CO(g)△H1CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
C(s)+O2(g)═CO2(g)△H3
CuO(s)+CO(g)═Cu(s)+CO2(g)△H4
2CuO(s)+C(s)═2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0 | B. | △H2>0 | C. | △H2=△H3-△H1 | D. | 2△H4<△H5 |
分析 A.以碳作为还原剂的反应通常为吸热反应;
B.所有的燃烧反应属于放热反应;
C.根据盖斯定律利用加合法进行分析;
D.根据盖斯定律利用加合法进行分析.
解答 解:A.碳还原二氧化碳的反应属于吸热反应,△H1>0,故A错误;
B.所有的燃烧反应属于放热反应,因此△H2<0,△H3<0,故B错误;
C.已知:①CO2(g)+C(s)═2CO(g)△H1,②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2,③C(s)+O2(g)═CO2(g)△H3
由盖斯定律可知(③-①)×$\frac{1}{2}$,因此△H2=$\frac{1}{2}$(△H3-△H1 ),故C错误;
D.①CuO(s)+CO(g)═Cu(s)+CO2(g)△H4
②2CuO(s)+C(s)═2Cu(s)+CO2(g)△H5
盖斯定律②-①×2得到,C(s)+CO2(g)═2CO(g),△H=△H5 -2△H4>0,2△H4<△H5,故D正确;
故选D.
点评 本题考查了常见的吸热反应和放热反应类型、盖斯定律的计算,题目难度中等,熟悉常见的吸热反应和放热反应类型、根据盖斯定律利用加合法进行有关计算的步骤是解题的关键.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.下列反应的离子方程式不正确的是( )
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-═2Fe2++S↓ | |
| C. | 将适量CO2通入NaClO溶液中(已知次氯酸的K1为2.95×10-8)ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
3. 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | a、b两点的平衡常数:Kb>Ka | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | b、c两点的反应速率:v(b)>v(c) |
10.下列有关化学用语表示正确的是( )
| A. | CF4的电子式: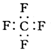 | B. | 对甲基苯酚的结构简式: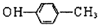 | ||
| C. | 甲酸甲酯的实验式:CH2O | D. | ${\;}_{8}^{16}$O2-离子的结构示意图: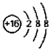 |
20.填上正确的除杂试剂和分离方法,来提纯下列物质(括号内为少量杂质).
| 序号 | 不纯物质 | 除杂试剂 | 分离方法 |
| ① | 苯(苯酚) | ||
| ② | 酒精(水) | ||
| ③ | 溴苯(Br2) | ||
| ④ | 乙烯(SO2) | ||
| ⑤ | 乙酸乙酯(乙酸) |
7.下列有关化学用语表示正确的是( )
| A. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 氟原子的结构示意图: | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | |
| D. | 碳酸钠的电离方程式:Na2CO3═Na2++CO32- |
4.在实验室,下列试剂中需要用棕色试剂瓶保存的是( )
| A. | 浓硝酸 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 浓氨水 |
13.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于64.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min)
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是AD
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
I.已知反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于64.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min)
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
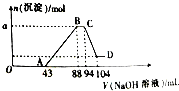 现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.