题目内容
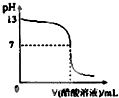 常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、pH=7时,所加醋酸溶液的体积为10mL |
| B、pH<7时,溶液中c(CH3COO-)<c(Na+) |
| C、醋酸滴入10ml时,c(Na+)═c(CH3COOH)+c(CH3COO-) |
| D、继续滴加0.1 mol?L-1醋酸溶液,溶液pH可以变为1 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使溶液呈中性,醋酸的物质的量应稍大些;
B、pH<7时,则c(H+)>(OH-),根据电荷守恒判断溶液中c(CH3COO-)、c(Na+)的大小;
C、当醋酸体积为10mL时,氢氧化钠与醋酸的物质的量相等,根据物料守恒判断;
D、根据醋酸是弱电解质,不可能完全电离,溶液中氢离子浓度一定小于0.1mol/L.
B、pH<7时,则c(H+)>(OH-),根据电荷守恒判断溶液中c(CH3COO-)、c(Na+)的大小;
C、当醋酸体积为10mL时,氢氧化钠与醋酸的物质的量相等,根据物料守恒判断;
D、根据醋酸是弱电解质,不可能完全电离,溶液中氢离子浓度一定小于0.1mol/L.
解答:
解:A、加醋酸溶液的体积为10mL时,两溶液恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,所以醋酸溶液的体积为大于10mL,故A错误;
B、当pH<7时,溶液显示酸性,则c(H+)>(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+(OH-)可知,c(CH3COO-)>c(Na+),故B错误;
C、当加入10mL醋酸时,等浓度、等体积的醋酸与氢氧化钠溶液恰好反应生成醋酸钠,根据物料守恒可得:c(Na+)=c(CH3COOH)+c(CH3COO-),故C正确;
D、醋酸是弱酸,不可能完全电离,0.1mol?L-1醋酸电离的氢离子浓度一定小于0.1mol/L,所以溶液pH一定大于1,故D错误;
故选C.
B、当pH<7时,溶液显示酸性,则c(H+)>(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+(OH-)可知,c(CH3COO-)>c(Na+),故B错误;
C、当加入10mL醋酸时,等浓度、等体积的醋酸与氢氧化钠溶液恰好反应生成醋酸钠,根据物料守恒可得:c(Na+)=c(CH3COOH)+c(CH3COO-),故C正确;
D、醋酸是弱酸,不可能完全电离,0.1mol?L-1醋酸电离的氢离子浓度一定小于0.1mol/L,所以溶液pH一定大于1,故D错误;
故选C.
点评:本题考查了溶液酸碱性的定性判断、溶液离子浓度的大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,明确电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小的方法.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
氯酸(HClO3)是一种强氧化性酸.若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是( )
| A、氯酸铜 | B、高氯酸铜 |
| C、氯化铜 | D、氢气 |
将一定量的由Na、Na2O、Na2O2组成的混合物与足量的水充分反应,收集到一定体积的混合气体,将混合气体通过放电后恰好完全反应,则原混合物中Na、Na2O、Na2O2物质的量之比为( )
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整. 某一位同学为了测定三聚氰胺的分子式,设计了如图实验:
某一位同学为了测定三聚氰胺的分子式,设计了如图实验: