题目内容
向5.0mL 0.20mol/L CuSO4溶液中滴加0.20mol/L的NaOH溶液,当加入7.5mL NaOH溶液时,溶液中Cu2+几乎全部沉淀,请给出沉淀物的化学式 .
考点:化学方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:计算题
分析:c (Cu2+)和c (OH-)的浓度(mol/L )相同,完全沉淀时V(Cu2+):V (OH-)=5.0:7.5=1.0:1.5,则沉淀中n(Cu2+):n (OH-)=1:1.5,根据电荷守恒可知,沉淀中含有SO42-,进而计算沉淀中n(Cu2+):n (OH-):n(SO42-),确定沉淀化学式.
解答:
解:c (Cu2+)和c (OH-)的浓度(mol/L )相同,完全沉淀时V(Cu2+):V (OH-)=5.0:7.5=1.0:1.5,则沉淀中n(Cu2+):n (OH-)=1:1.5,根据电荷守恒可知,沉淀中含有SO42-,(Cu2+):n (OH-):n(SO42-)=1:1.5:
=4:6:1,故沉淀化学式为:3Cu(OH)2?CuSO4,
故答案为:3Cu(OH)2?CuSO4.
| 1×2-1.5 |
| 2 |
故答案为:3Cu(OH)2?CuSO4.
点评:本题考查物质化学式的确定,难度中等,注意根据电荷守恒确定沉淀中硫酸根的量.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
加拿大阿尔贡天文台在星际间发现了HC9N链状分子,其结构式为:CH≡C-C≡C-C≡C-C≡C-C≡N,这是人类发现的最重星际有机分子,有关该分子的说法不正确的是( )
| A、该物质属于不饱和烃 |
| B、该分子碳、氮原子均满足8电子结构 |
| C、该分子所有原子处在一条直线上 |
| D、1mol该物质在一定条件下可与8molH2发生加成反应 |
用向硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕黄色,有关叙述有:
①向溶液里滴入淀粉溶液显蓝色;
②逸出的气泡是HI;
③离子方程式为:H2O2+2I-=I2+O2+2H+;
④离子方程式为:H2O2+2I-+2H+=I2+2H2O;
⑤反应时还有H2O2分解为水和O2,
其正确的是( )
①向溶液里滴入淀粉溶液显蓝色;
②逸出的气泡是HI;
③离子方程式为:H2O2+2I-=I2+O2+2H+;
④离子方程式为:H2O2+2I-+2H+=I2+2H2O;
⑤反应时还有H2O2分解为水和O2,
其正确的是( )
| A、①④⑤ | B、①②④ |
| C、③④⑤ | D、①③⑤ |
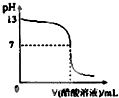 常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、pH=7时,所加醋酸溶液的体积为10mL |
| B、pH<7时,溶液中c(CH3COO-)<c(Na+) |
| C、醋酸滴入10ml时,c(Na+)═c(CH3COOH)+c(CH3COO-) |
| D、继续滴加0.1 mol?L-1醋酸溶液,溶液pH可以变为1 |
 有机物X的结构用键线式表示如图
有机物X的结构用键线式表示如图
 如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:
如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题: