题目内容
8.糖是人们日常生活中不可缺少的一类重要物质,下列有关糖类物质的叙述中,正确的是( )| A. | 葡萄糖在酒化酶作用下水解生成乙醇和二氧化碳 | |
| B. | 淀粉、纤维素都是天然有机高分子化合物,分子式都写成(C6H10O5)n,二者互为同分异构体 | |
| C. | 蔗糖与麦芽糖互为同分异构体 | |
| D. | 蔗糖、麦芽糖、淀粉和纤维素都能水解且水解的最终产物都是葡萄糖 |
分析 A.在酿酒过程中淀粉在酶的作用下转化为葡萄糖,葡萄糖在酒化酶作用下转化为乙醇和二氧化碳,葡萄糖是单糖不水解;
B.同分异构体具有相同的分子式和不同的结构;
C.蔗糖分子式为C12H22O11,与麦芽糖互为同分异构体,蔗糖的分子结构中不含醛基;
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖.
解答 解:A.葡萄糖是单糖不水解,葡萄糖在酒化酶作用下转化为乙醇和二氧化碳,属于氧化反应,故A错误;
B.淀粉和纤维素化学式都可表示为(C6H10O5)n,但是二者聚合度n不同,所以分子式不同,不属于同分异构体,故B错误;
C.蔗糖和麦芽糖的分子式均为C12H22O11,分子式相同但结构不同,蔗糖分子中不含醛基,麦芽糖分子中含有醛基,具有还原性,所以蔗糖与麦芽互为同分异构体,故C正确.
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖,故D错误;
故选C.
点评 本题考查物质的性质,题目难度中等,本题注意把握常见物质的性质是解题的关键,纤维素和淀粉的结构和性质,注意二者都是聚合物,但是聚合度不同.

练习册系列答案
相关题目
18.某有机物的结构简式为 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成反应 ②消去反应 ③水解反应 ④酯化反应 ⑤氧化反应 ⑥加聚反应.
 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )①加成反应 ②消去反应 ③水解反应 ④酯化反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
19.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 干冰汽化 | C. | NaOH熔化 | D. | HCl溶于水 |
16.下列反应中,与其它三个反应不属于同一类型的反应是( )
| A. |  $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$ $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$ | |
| B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3-CH2Cl | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
3.有五种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填空:
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)离子半径:B小于(填“大于”或“小于”)A.
(3)C原子的轨道表示式是 ,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
(4)D原子的电子排布式为1s22s22p63s23p5.
(5)C、E元素的第一电离能的大小关系是N>O(用元素符号表示).
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| E | L层上有2对成对电子 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)离子半径:B小于(填“大于”或“小于”)A.
(3)C原子的轨道表示式是
 ,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5.
(5)C、E元素的第一电离能的大小关系是N>O(用元素符号表示).
13.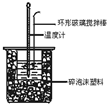 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
20.用NA表示阿伏加德罗常数值,下列说法正确的是( )
| A. | 25℃时,pH=12的1.0L的NaClO溶液中水电离出的OH-的数目为0.01NA | |
| B. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | |
| C. | 标准状况下,22.4L氯气与足量NaOH溶液反应转移的电子数为2NA | |
| D. | 同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
18.下列递变规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | B. | I2、Br2、Cl2氧化性依次减弱 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、F最高正价依次降低 |