题目内容
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-总数为0.1NA | |
| B. | 16g16O2和18g18O2中含有的质子数均为8NA | |
| C. | 1molFe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水所得溶液中含有的氯离子数为0.1NA |
分析 A、硫酸氢钠在溶液中完全电离为钠离子、氢离子和硫酸根离子;
B、16O2和18O2分别由16O和18O原子构成;
C、铁和足量的稀硝酸反应后变为+3价;
D、氯气和水的反应为可逆反应.
解答 解:A、硫酸氢钠在溶液中完全电离为钠离子、氢离子和硫酸根离子,即溶液中无硫酸氢根离子,故A错误;
B、16O2和18O2分别由16O和18O原子构成,故16g16O2和18g18O2中含有的16O和18O原子的物质的量均为1mol,而16O和18O原子中均含8个质子,故1mol16O和18O原子中含有的质子数均为8NA个,故B正确;
C、铁和足量的稀硝酸反应后变为+3价,故1mol铁反应后转移3NA个电子,故C错误;
D、氯气和水的反应为可逆反应,不能进行彻底,且生成的是HCl和HClO,故溶液中的氯离子个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
4.下列说法与对应化学反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用氯化铁溶液腐蚀电路板:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 硫酸镁溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 钠和冷水反应:Na+H2O═Na++OH-+H2↑ |
2.用下列实验装置完成对应实验(部分仪器已省略)不能达到实验目的是( )
| A. | 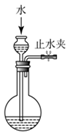 检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 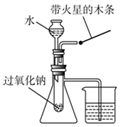 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
9.甲、乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入足量的铝粉,反应结束后再同条件下测得生成的气体体积比为( )
| A. | 1:1 | B. | 1:3 | C. | 1:2 | D. | 3:1 |
19.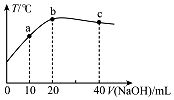 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
6.为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氮氧化物、碳氧化物含量显得尤为重要.
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),下列各项能说明该反应达到平衡状态的是abc.
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2,同时生成2molNO2
(2)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H>0(填“>”或“<”).
(3)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1.
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)?CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
①根据上表数据,请比较T1>T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=50%,该温度下的化学平衡常数为4.
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)<v (逆)(选填“>”、“<”或“=”),判断的理由是拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆).
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$(用含a和b的代数式表示)
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)?2NO2(g),下列各项能说明该反应达到平衡状态的是abc.
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2,同时生成2molNO2
(2)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H>0(填“>”或“<”).

(3)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1.
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)?CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)<v (逆)(选填“>”、“<”或“=”),判断的理由是拔去铆钉,容器是在同温同压下进行,体积之比等于物质的量之比,当冲入6molCO,假设平衡不移动,此时容器的体积为6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆).
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$(用含a和b的代数式表示)
3.关于下列各装置图的叙述中,不正确的是( )
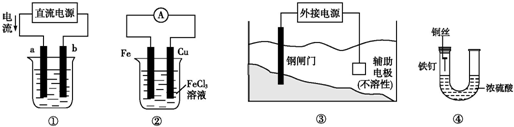

| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
4.在铜与浓硝酸反应的化学方程式中,没有生成的物质是( )
| A. | Cu(NO3)2 | B. | H2 | C. | NO2 | D. | H2O |