题目内容
向20mL 0.5mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法错误的是( )


| A、从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+) |
| B、由水电离的c(H+):b点>c点 |
| C、氨水的电离平衡常数:b点>a点 |
| D、b焦到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:酸碱中和反应是放热反应,所以酸碱中和过程中溶液温度升高,氨水是弱电解质,在水溶液里存在电离平衡,溶液越稀氨水的电离程度越大,氨水电离过程吸热,温度越高,氨水电离程度越大;酸或碱溶液抑制水电离,含有弱根离子的盐促进水电离,结合电荷守恒来分析解答.
解答:
解:A.如果c(Cl-)=c(NH4+),根据电荷守恒知,溶液中c(OH-)=c(H+),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其溶液呈中性,则氨水应该稍微过量,所以从a点到b点,混合溶液中可能存在:c(Cl-)=c(NH4+),故A错误;
B.b点酸碱恰好反应生成氯化铵,c点盐酸过量,盐酸抑制水电离,氯化铵促进水电离,所以由水电离出的c(H+):b点>c点,故B正确;
C.氨水是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,氨水的电离程度越大,其电离常数越大,故C正确;
D.从b点到c点,盐酸过量,溶液中的溶质是氯化铵和盐酸,当盐酸的物质的量大于氯化铵的物质的量时,混合溶液中存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-),故D正确;
故选A.
B.b点酸碱恰好反应生成氯化铵,c点盐酸过量,盐酸抑制水电离,氯化铵促进水电离,所以由水电离出的c(H+):b点>c点,故B正确;
C.氨水是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,氨水的电离程度越大,其电离常数越大,故C正确;
D.从b点到c点,盐酸过量,溶液中的溶质是氯化铵和盐酸,当盐酸的物质的量大于氯化铵的物质的量时,混合溶液中存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-),故D正确;
故选A.
点评:本题考查酸碱混合溶液定性判断,根据弱电解质、含有弱根离子盐的性质结合电荷守恒来分析解答,难度中等.

练习册系列答案
相关题目
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
下列化学反应对应的离子方程式表示正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
某一元弱酸HA的相对分子质量为M.在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg?cm-3,其中n(A-)为bmol.下列叙述,错误的是( )
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|
下列实验操作能达到目的是( )
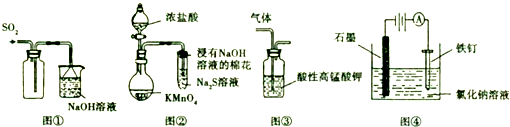

| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
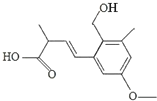 某有机物的结构简式如图,下列叙述正确的是( )
某有机物的结构简式如图,下列叙述正确的是( )| A、该有机物的分子式为C14H20O4 |
| B、该有机物能发生取代、加成和聚合反应 |
| C、1mol该有机物最多能与3mol NaOH反应 |
| D、该有机物分子中所有碳原子一定共平面 |
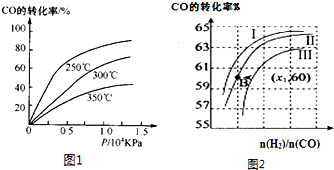
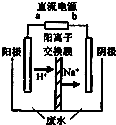
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.