题目内容
13.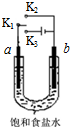 用如图装置研究电化学原理,下列分析中错误的是( )
用如图装置研究电化学原理,下列分析中错误的是( )| 选项 | 连接 | 电极材料 | 分析 | |
| a | b | |||
| A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
| B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
| C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
| D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.在中性条件下,铁发生吸氧腐蚀;
B.Zn、Fe形成原电池,Fe作正极被保护;
C.Fe作阴极,阴极上氢离子得电子,石墨作阳极,阳极上氯离子失电子;
D.Fe作阳极,Fe失电子.
解答 解:A.在中性条件下,铁作负极失电子,石墨作正极,正极上氧气得电子生成氢氧根离子,则Fe发生吸氧腐蚀,故A正确;
B.Zn、Fe形成原电池,Zn作负极被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,故B正确;
C.Fe作阴极,阴极上氢离子得电子,石墨作阳极,阳极上氯离子失电子,电解氯化钠溶液生成氢气、氯气和氢氧化钠,故C正确;
D.Fe与正极相连,Fe作阳极,Fe失电子,被腐蚀,Fe不能被保护,故D错误.
故选D.
点评 本题考查了金属的电化学腐蚀和防护,侧重于考查学生对原电池原理和电解池原理的应用能力,题目难度不大.

练习册系列答案
相关题目
8.下列对浓硫酸的叙述正确的是( )
| A. | 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸 | |
| B. | 浓硫酸具有吸水性,故能使蔗糖碳化 | |
| C. | 浓硫酸和铜片加热既表现出酸性,又表现出氧化性 | |
| D. | 浓H2SO4可做H2、O2等气体的干燥剂表现其脱水性 |
5.1838年李比希提出了“基团”的定义,从此,有机化学中“基团”概念就确定了,下列有机基团的表达式不正确的是( )
| A. | 甲基-CH3 | B. | 羟基-OH- | C. | 醛基-CHO | D. | 羧基-COOH |
2.某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液.
查阅资料得知:淀粉遇I2变蓝.
请帮助他们完成以下实验报告:
填空:
①验证Fe2+具有还原性③2Fe2++Cl2══2Fe3++2Cl- ⑤证明Fe2+具有氧化性⑧2Fe3++Fe══3Fe2+⑩证明Fe3+具有氧化性
综合以上实验,你能得到的结论是:⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可Fe2++2OH-=2Fe(OH)2↓.
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.保存亚铁盐溶液时如何防止亚铁盐被氧化加入少量铁粉.
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀.
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液.
查阅资料得知:淀粉遇I2变蓝.
请帮助他们完成以下实验报告:
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 | / | ⑤ | Zn+Fe2+═Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
| 实验4 | ⑨ | 在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 | 淀粉溶液变蓝 | ⑩ | 2Fe3++2I-═2Fe2++I2 |
①验证Fe2+具有还原性③2Fe2++Cl2══2Fe3++2Cl- ⑤证明Fe2+具有氧化性⑧2Fe3++Fe══3Fe2+⑩证明Fe3+具有氧化性
综合以上实验,你能得到的结论是:⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可Fe2++2OH-=2Fe(OH)2↓.
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.保存亚铁盐溶液时如何防止亚铁盐被氧化加入少量铁粉.
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀.
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
3.已知氯水中存在反应:Cl2+H2O?H++Cl-+HClO,取5mL饱和氯水进行如下实验.下列说法中,正确的是( )
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |