题目内容
常温下,下列说法正确的是( )
| A、往CH3COOH溶液中加水,c(OH-)和c(H+)均增大 |
| B、物质的量浓度均为0.1mol?1-1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)>(CH3COO-) |
| C、某浓度的氯化铵溶液中存在c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.加水稀释促进醋酸电离,但溶液中c(H+)减小、c(OH-)增大;
B.二者恰好反应生成醋酸钠,溶液呈碱性,再结合电荷守恒判断;
C.氯化铵为强酸弱碱盐,溶液呈酸性,再结合电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B.二者恰好反应生成醋酸钠,溶液呈碱性,再结合电荷守恒判断;
C.氯化铵为强酸弱碱盐,溶液呈酸性,再结合电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.加水稀释促进醋酸电离,但溶液中c(H+)减小,温度不变,水的离子积常数不变,则c(OH-)增大,故A错误;
B.二者恰好反应生成醋酸钠,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒得c(Na+)>(CH3COO-),故B正确;
C.氯化铵为强酸弱碱盐,溶液呈酸性,则c(H+)>(HO-),再结合电荷守恒得c(NH4+)<c(Cl-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(Cl-)+c(OH-),故D正确;
故选BD.
B.二者恰好反应生成醋酸钠,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒得c(Na+)>(CH3COO-),故B正确;
C.氯化铵为强酸弱碱盐,溶液呈酸性,则c(H+)>(HO-),再结合电荷守恒得c(NH4+)<c(Cl-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(Cl-)+c(OH-),故D正确;
故选BD.
点评:本题考查了弱电解质的电离、盐类水解,明确溶液中的溶质及溶液酸碱性再结合守恒思想解答即可,易错选项是D,电解质溶液中存在电荷守恒与溶液酸碱性无关,为易错点.

练习册系列答案
相关题目
室温下有下列四种溶液:①0.1mol?L-1氨水 ②0.1mol?L-1NH4Cl溶液 ③含有0.1mol?L-1盐酸和0.1mol?L-1 NH4Cl的混合溶液 ④含有0.1mol?L-1 NaOH溶液和0.1mol?L-1氨水的混合溶液,四种溶液中c(NH4+)由小到大排列正确的是( )
| A、②③④① | B、④①②③ |
| C、①④②③ | D、③②①④ |
以下元素的原子半径递变规律正确的是( )
| A、Be<B<Na<Mg |
| B、B<Be<Mg<Na |
| C、Be<B<Mg<Na |
| D、B<Be<Na<Mg |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氮原子的氮气在标准状况下的体积约为22.4 L |
| B、标准状况下,11.2 L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2 L Cl2含有的分子数为0.5NA |
| D、25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA |
相对分子质量为M的气态化合物V L(标准状况),溶于mg水中,得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρ g?cm-3,则下列说法正确的是( )
A、溶质的质量分数w%=
| ||
B、溶液密度ρ=
| ||
C、物质的量浓度c=
| ||
D、相对分子质量M=
|
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L氧气做氧化剂时转移的电子数一定是4NA |
| B、1mol硝基(-NO2)与NA个二氧化氮(NO2)分子所含的电子数相等 |
| C、80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.24NA |
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
250mL物质的量浓度为2mol?L-1的硫酸溶液,下列说法正确的是( )
| A、取50ml该溶液,含硫酸的物质的量为10mol?L-1 |
| B、含硫酸的物质的量为0.5mol |
| C、含硫酸的物质的量为2mol?L-1 |
| D、含硫酸的物质的量为1mol |
下列说法中正确的是( )
| A、两个原子之间形成共价键时,最多有一个σ键 |
| B、气体单质中,一定有σ键,可能有π键 |
| C、[Cu(NH3)4]2+和CH4两个粒子中中心原子Cu和C都是通过sp3杂化轨道成键 |
| D、中心原子采用sp2,该分子一定是平面三角形 |
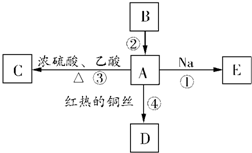 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示: