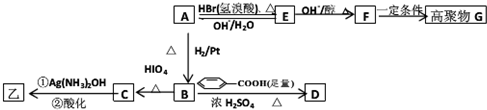
题目内容
检查烧碱中是否混有纯碱,以下方法可行的是( )
①加热是否有气体产生
②溶解后检验溶液的酸碱性
③滴加盐酸是否有气体产生
④加入到氯化钙溶液中是否有沉淀产生.
①加热是否有气体产生
②溶解后检验溶液的酸碱性
③滴加盐酸是否有气体产生
④加入到氯化钙溶液中是否有沉淀产生.
| A、③④ | B、①③ | C、①③④ | D、①② |
考点:物质的检验和鉴别的基本方法选择及应用
专题:
分析:NaOH中是否含有Na2CO3,主要根据碳酸钠与氢氧化钠的性质差异来选用合适的试剂,碳酸钠与盐酸、氯化钙反应的现象明显,以此来解答.
解答:
解:①Na2CO3受热不容易分解,所以加热无现象,故不选;
②NaOH的溶液显碱性,Na2CO3的溶液也显碱性,则溶于水后检验溶液是否显碱性,不能判断氢氧化钠是否混有纯碱,故不选;
③碳酸钠与盐酸反应生成气体,NaOH与盐酸反应生成氯化钠和水,则生成气体可判断含纯碱,故选;
④Na2CO3能与氯化钙溶液反应生成碳酸钙白色沉淀,而氢氧化钠与氯化钙不反应,所以溶于水后滴加稀氯化钙溶液观察有沉淀产生,说明含有碳酸钠,故选;
故选A.
②NaOH的溶液显碱性,Na2CO3的溶液也显碱性,则溶于水后检验溶液是否显碱性,不能判断氢氧化钠是否混有纯碱,故不选;
③碳酸钠与盐酸反应生成气体,NaOH与盐酸反应生成氯化钠和水,则生成气体可判断含纯碱,故选;
④Na2CO3能与氯化钙溶液反应生成碳酸钙白色沉淀,而氢氧化钠与氯化钙不反应,所以溶于水后滴加稀氯化钙溶液观察有沉淀产生,说明含有碳酸钠,故选;
故选A.
点评:本题考查了物质的检验,为高频考点,注意把握物质的性质的差异选择合适的试剂,利用明显的现象来判断,侧重性质及应用能力的考查,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8.则下列说法正确的是( )
| A、新制氯水与碳酸氢钠不反应 |
| B、25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C、25℃时,等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pHpH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
| D、25℃时,PH=9的NaHCO3溶液中:C(HCO3-)>C(CO32-)>C(H2CO3) |
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )


| A、升高温度,平衡向逆反应方向移动 |
| B、使用催化剂,C的物质的量分数增加 |
| C、化学方程式系数a<c+d |
| D、根据图象无法确定改变温度后平衡移动方向 |
下列关于物质分类的说法正确的是( )
| A、油脂、糖类、蛋白质均是天然高分子化合物 |
| B、三氯甲烷、氯乙烯、三溴苯酚均是卤代烃 |
| C、CaCl2、烧碱、聚苯乙烯均为化合物 |
| D、稀豆浆、硅酸、雾霾均为胶体 |
在5NH4NO3
2HNO3+4N2+9H2O的反应中,发生氧化反应的氮原子与发生还原反应的氮原子的个数之比是( )
| ||
| A、5:8 | B、5:4 |
| C、5:3 | D、3:5 |
同温同压下,甲、乙两容器分别盛有CH4和NH3,已知它们所含氢原子个数相同,则甲、乙两容器的体积比为( )
| A、4:3 | B、5:4 |
| C、4:5 | D、3:4 |