题目内容
10.某小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质.
操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯.
(1)烧瓶中所进行反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)图I中饱和食盐水的作用是除去氯气中的HCl.
(3)图I中盛NaOH溶液的瓶中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图.
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液.他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液.(已知:Na2SO3溶液显碱性,Na2SO4溶液显中性)
提出猜想:
Ⅰ.NaClO把Na2SO3氧化成Na2SO4;
Ⅱ.NaClO把酚酞氧化了;
Ⅲ.NaClO把Na2SO3和酚酞都氧化了.
①下列实验方案中,要证明NaClO氧化了Na2SO3的最佳实验方案是bd.
a.向混合后的溶液中加入过量氯化钡溶液
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入氯化钡溶液
d.向混合后的溶液中加入氢氧化钡溶液,过滤后,在沉淀中加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化.
分析 (1)由装置可知烧瓶中为二氧化锰与浓盐酸制取氯气的反应;
(2)浓盐酸易挥发,制得的氯气中有氯化氢气体,用饱和食盐水除去氯化氢气体;
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠;
(4)收集氯气可用排空气法或者拍饱和食盐水的方法;
(5)①要证明NaClO氧化了Na2SO3的实验,应验证生成物中的硫酸根离子存在;
②依据酚酞遇碱溶液变红设计实验进行分析判断.
解答 解:(1)烧瓶为二氧化锰与浓盐酸制取氯气的反应,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)浓盐酸易挥发,制得的氯气中有氯化氢气体,用饱和食盐水除去氯化氢气体;
故答案为:除去氯气中的HCl;
(3)图I中盛NaOH溶液的瓶中反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)收集氯气需要利用排饱和氯化钠溶液的方法收集,导气管短进长出,或者排空气法,氯气密度比空气大,导气管长进短出,装置图为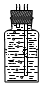 或
或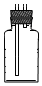 ;
;
故答案为: 或
或 ;
;
(5)①要证明NaClO氧化了Na2SO3的实验,应验证生成物中的硫酸根离子存在;
a.向混合后的溶液中加入过量盐酸,无现象说明,故a不符合;
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,生成白色沉淀证明生成硫酸钡沉淀,证明亚硫酸钠被氧化为硫酸钠,故b符合;
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液,硝酸具有氧化性可以氧化亚硫酸钠为硫酸钠也可以生成硫酸银沉淀干扰氯离子的检验,故c不符合;
d.向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,再加入过量盐酸沉淀不溶证明原溶液中生成了硫酸钠,证明亚硫酸钠被氧化,故d符合;
故答案为:bd;
②酚酞试液遇碱变红,为证明NaClO氧化了酚酞向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化;
故答案为:向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化.
点评 本题考查了物质的制备,涉及氯气的性质验证和实验方案的设计,掌握实验基础和明确物质的性质是解题关键,题目难度中等.

| A. | 配制100g20%的氢氧化钠溶液(烧杯、100mL容量瓶、胶头滴管) | |
| B. | 钠的焰色反应(铂丝、硫酸钠溶液、稀盐酸) | |
| C. | 从碘水中提取碘(蒸发皿、酒精灯、玻璃棒) | |
| D. | 除去自来水中的Cl-(铁架台、玻璃棒、漏斗) |
| A. | Na→Na2O2 | B. | SO2→S | C. | NaHCO3→CO2 | D. | HCl→H2 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)在一定条件下的溶液中,反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,加入少量KCl固体,能使平衡不移动(填“正向”、“逆向”、“不”)
(3)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+CO2↑.
(4)常温下,一定体积PH=2的二元弱酸H2R溶液与等体积PH=12的NaOH溶液混合,该混合溶液中电荷守恒的关系式是c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-).
| A. | MgO、Al2O3熔点高,均可用作耐高温材料 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |




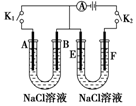 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ