题目内容
18.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示.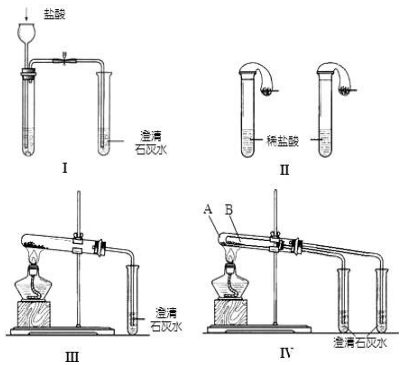
试回答:
(1)只根据图Ⅰ、Ⅱ所示实验,能够到达实验目的是(填装置序号)Ⅱ;用此装置鉴别Na2CO3和NaHCO3的现象是产生气体快的是碳酸氢钠,慢的是碳酸钠.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、CO2+Ca(OH)2=CaCO3↓+H2O与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)D;
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全 C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不能
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是NaHCO3;有的同学在盛Na2CO3 的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解.你认为此观点错误(添“正确”或“错误”).分析产生此现象的原因为装置中的空气热胀冷缩也会有气泡产生
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.
①当石灰水过量时,其离子方程式为HCO3-+OH-+Ca2+═CaCO3↓+H2O;
②将碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为Na2CO3请设计实验检验所得溶液中溶质的阴离子取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
分析 (1)碳酸钠和碳酸氢钠均与盐酸反应气体,但生成气体的快慢及多少不同;
(2)图Ⅲ、Ⅳ中,均发生碳酸氢钠的分解生成二氧化碳,实验Ⅳ具有对比性;
(3)碳酸氢钠不稳定,加热易分解;开始加热时,压强增大,会产生气泡;
(4)①当石灰水过量时,反应生成碳酸钙、NaOH和水;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,反应生成碳酸钙、碳酸钠和水.
解答 解:(1)碳酸钠和碳酸氢钠均与盐酸反应气体,但生成气体的快慢及多少不同,图I不能判断,而图Ⅱ可观察气球变化鉴别,产生气体快的是碳酸氢钠,慢的是碳酸钠,
故答案为:Ⅱ;产生气体快的是碳酸氢钠,慢的是碳酸钠;
(2)图Ⅲ、Ⅳ中,均发生碳酸氢钠的分解生成二氧化碳,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑及CO2+Ca(OH)2=CaCO3↓+H2O,由图中装置及性质可知,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、CO2+Ca(OH)2=CaCO3↓+H2O; D;
(3)碳酸氢钠不稳定,加热易分解,则试管B中装入的固体最好是NaHCO3,碳酸钠在加热时不分解,之所以产生气泡,原因是装置中的空气热胀冷缩也会有气泡产生,
故答案为:NaHCO3;错误; 装置中的空气热胀冷缩也会有气泡产生;
(4)①当石灰水过量时,反应生成碳酸钙、NaOH和水,离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故答案为:HCO3-+OH-+Ca2+═CaCO3↓+H2O;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,反应生成碳酸钙、碳酸钠和水,所得溶液中溶质的化学式为Na2CO3,检验碳酸根离子,可取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-,
故答案为:Na2CO3;取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
点评 本题考查碳酸钠和碳酸氢钠的性质探究及鉴别,为高频考点,把握图中装置的作用及实验原理为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.

 巧学巧练系列答案
巧学巧练系列答案| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
| A. | 涂改液危害人体健康、污染环境 | |
| B. | 中学生最好不用或慎用涂改液 | |
| C. | 苯的同系物和卤代烃皆可溶于水 | |
| D. | 苯的同系物和卤代烃是涂改液中的溶剂 |
 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)