题目内容
X、Y、Z三种短周期元素分别位于不同周期.已知X和Y原子最外层的电子数相同,Z原子次外层只有2个电子,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z.回答下列问题:
(1)元素符号:X是 ,Y是 ,Z是 .
(2)X2Z的电子式是 ,Y2Z的电子式是 .
(1)元素符号:X是
(2)X2Z的电子式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Z原子次外层只有2个电子,所以Z是第二周期元素,X、Y、Z三种短周期元素,分别位于不同的周期,则X和Y位于第一、第三周期;
X和Y原子最外层电子数相同,所以X和Y位于同一主族,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z,则Y为H元素,X为Na元素,Z为O元素,据此进行答题.
X和Y原子最外层电子数相同,所以X和Y位于同一主族,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z,则Y为H元素,X为Na元素,Z为O元素,据此进行答题.
解答:
解:Z原子次外层只有2个电子,所以Z是第二周期元素,X、Y、Z三种短周期元素,分别位于不同的周期,则X和Y位于第一、第三周期,X和Y原子最外层电子数相同,所以X和Y位于同一主族,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z,则Y为氢元素,X为钠元素,Z为氧元素,
(1)根据上面的分析可知,X、Y、Z三种元素分别为Na、H、O,故答案为:Na;H;O;
(2)X为Na、Z为O元素,则X2Z为氧化钠,氧化钠属于离子化合物,钠离子直接用离子符号表示,氧离子需要标出所带电荷及最外层电子,氧化钠的电子式为: ;
;
Y2Z为水,水为共价化合物,分子中存在两个氧氢键,水的电子式为: ,故答案为:
,故答案为: ;
; .
.
(1)根据上面的分析可知,X、Y、Z三种元素分别为Na、H、O,故答案为:Na;H;O;
(2)X为Na、Z为O元素,则X2Z为氧化钠,氧化钠属于离子化合物,钠离子直接用离子符号表示,氧离子需要标出所带电荷及最外层电子,氧化钠的电子式为:
 ;
;Y2Z为水,水为共价化合物,分子中存在两个氧氢键,水的电子式为:
 ,故答案为:
,故答案为: ;
; .
.
点评:本题考查了位置、结构与性质的相互关系及其应用,题目难度中等,正确推断元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及书写方法.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A、硫酸、纯碱、氯化钙 |
| B、盐酸、烧碱、硫酸铜 |
| C、碳酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钾 |
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )


| A、原子半径的大小为:Z>Y>X |
| B、气态氢化物的还原性:Z<Y |
| C、若Y可作半导体材料,则X、Z的单质常温下均为气体 |
| D、若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
下列关于热化学反应的描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+2×283.0kJ?mol-1 |
| C、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D、1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
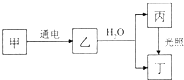 甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).
甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).