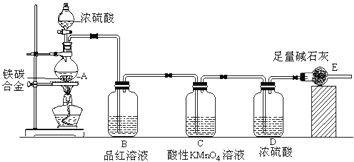
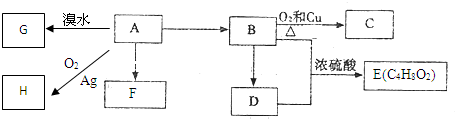
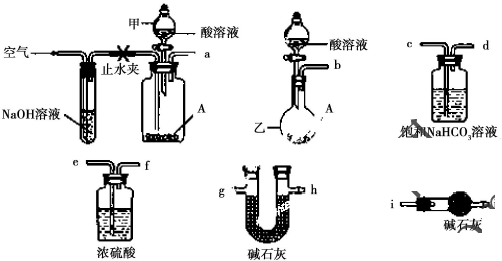
题目内容
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )


| A、原子半径的大小为:Z>Y>X |
| B、气态氢化物的还原性:Z<Y |
| C、若Y可作半导体材料,则X、Z的单质常温下均为气体 |
| D、若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z三种短周期元素,则三种元素的原子序数不大于18,X与Z、Y的族序数分别相差1,则X处于第二周期,Y、Z处于第三周期,
A.同一周期,元素的原子半径随着原子序数的增大而减小,电子层数越多,原子半径越大;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,水中存在氢键,据此判断即可.
A.同一周期,元素的原子半径随着原子序数的增大而减小,电子层数越多,原子半径越大;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,水中存在氢键,据此判断即可.
解答:
解:X、Y、Z三种短周期元素,则三种元素的原子序数不大于18,X与Z、Y的族序数分别相差1,则X处于第二周期,Y、Z处于第三周期,
A、同一周期,原子序数越小,半径越大,Y>Z,故A错误;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱,Z的非金属性强于Y,故气态氢化物的还原性:Z<Y,故B正确;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体,故C错误;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,O的氢化物为水,Z的氢化物为HCl,由于水中存在氢键,故水比氯化氢的熔沸点高,故D错误,
故选B.
A、同一周期,原子序数越小,半径越大,Y>Z,故A错误;
B.同一周期,元素的非金属性随着原子序数的增大而增大,非金属性越强,则其氢化物越稳定,其还原性越弱,Z的非金属性强于Y,故气态氢化物的还原性:Z<Y,故B正确;
C.若Y可作半导体材料,即Y为Si,则X为N、Z为S,S常温下为固体,故C错误;
D.若Y与Z的核电荷数之和为X的4倍,设X为a,则Y为a+7、Z为a+9,即a+7+a+9=4a,解a=8,那么X为O,Y为P,Z为Cl,O的氢化物为水,Z的氢化物为HCl,由于水中存在氢键,故水比氯化氢的熔沸点高,故D错误,
故选B.
点评:本题主要考查元素位置结构性质的关系,明确元素周期律是解本题的关键,注意气态氢化物的稳定性与其还原性相反,为易错点.

练习册系列答案
相关题目
决定气体体积的因素是:①气体分子的直径 ②气体的物质的量多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
| A、①② | B、①③ | C、②③ | D、②④ |
立方烷、棱晶烷和盆烯是近年来运用有机合成方法制备的具有如下图所示立体结构的环状有机物,对上述有机物的说法正确的是( )

| A、立方烷、棱晶烷和盆烯都不能使溴水褪色 |
| B、棱晶烷和盆烯互为同分异构体 |
| C、立方烷的二氯代物共有3种 |
| D、立方烷、棱晶烷中C原子都形成4个单键,因此它们都属于烷烃 |
要测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是( )
| A、逸出气体若用碱石灰吸收,增重b克.则测定混合物中Na2CO3的质量分数偏小 |
| B、把所得溶液加热蒸干,并灼烧至恒重,得b克固体.蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D、产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
实验室将NaClO3和Na2SO3按物质的量之比2:1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
| A、Cl2 |
| B、Cl2O |
| C、ClO2 |
| D、Cl2O3 |