题目内容
已知:C(s)+CO2(g)═2CO(g)△H>0,该反应达到平衡后,改变下列条件都有利于反应向正方向进行的是( )
| A、升高温度和减小压强 |
| B、降低温度和减小压强 |
| C、降低温度和增大压强 |
| D、升高温度和增大压强 |
考点:化学平衡的影响因素
专题:
分析:根据升温时平衡正向移动,减小压强化学平衡向正反应方向移动来分析能使平衡向正反应方向移动的措施.
解答:
解:对于反应A(g)+B(s)?2C(g)△H>0,反应是气体体积增大的吸热反应,升高温度和减小压强促进反应正向进行,
故选A.
故选A.
点评:本题考查了化学平衡移动原理的应用,注意反应特征的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
在含有Fe3+、Al3+、Fe2+、NH4+的溶液中,加入足量的Na202固体,充分反应后,再加入过量的稀盐酸,完全反应后,溶液中离子数目没有变化的是( )
| A、Fe3+ | ||
| B、Fe2+ | ||
| C、Al3+ | ||
D、N
|
 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
下列各组离子在指定溶液中,一定能大量共存的是( )
| A、加入KSCN显红色的溶液中:Na+、Cu2+、Cl-、I- |
| B、c(CO32-)=0.1mol/L的溶液中:K+、Na+、Cl-、I- |
| C、c(H+)/c(OH-)=1012的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
关于反映4Al+3TiO2+3C═2Al2O3+3TiC的叙述正确的是( )
| A、Al是还原剂,TiC是氧化产物 |
| B、TiO2是氧化剂,TiC是还原产物 |
| C、反应中氧化剂与还原剂的物质的量之比是1:1 |
| D、生成1molTiC时转移4mol电子 |
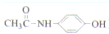 )(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成
)(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成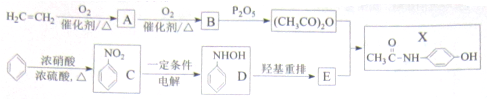
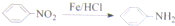 .请回答下列问题:
.请回答下列问题: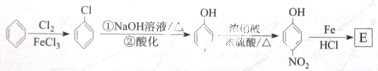
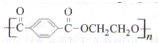 .请设计合成路线(无机试剂及溶剂任选)
.请设计合成路线(无机试剂及溶剂任选) 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )