题目内容
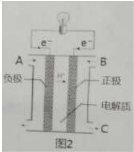
目前,科学家正在研究开发一种高能电池--钠硫电池,它以熔融钠、硫为两极,以导电的β-A2lO3陶瓷作固体电解质,反应式如下:Na2SX
2Na+xS以下说法正确的是( )
| ||
| 放电 |
| A、放电时,Na作正极,S极发生还原反应 |
| B、放电时,Na发生还原反应 |
| C、充电时,钠极与外电源的正极相连 |
| D、充电时,阳极发生的反应为:SX2--2e=xS |
考点:原电池和电解池的工作原理
专题:
分析:在放电时,原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;原电池负极发生失电子的氧化反应,在反应2Na+xS=Na2Sx中钠失电子,故负极反应为2Na-2e-=2Na+,在充电时,电解池的阳极发生的电极反应极为正极上的逆反应,阴极反应和负极互为逆反应.
解答:
解:A、在放电时,硫单质得电子,发生还原反应,钠失电子,作负极,故A错误;
B、放电时,钠失电子,作负极,发生氧化反应,故B错误;
C、充电时,钠极与外电源的负极相连,发生还原反应,故C错误;
D、充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故D正确;
故选D.
B、放电时,钠失电子,作负极,发生氧化反应,故B错误;
C、充电时,钠极与外电源的负极相连,发生还原反应,故C错误;
D、充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故D正确;
故选D.
点评:本题考查了二次电池的工作原理以及电极反应式的书写知识,放电和充电过程的实质判断,依据电子守恒进行电极产物的计算,可以根据教材知识来回答,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列各组物质中,肯定是同系物的是( )
| A、甲苯和邻甲基乙苯 |
| B、CH2=CH2和 C6H5-CH=CH2 |
| C、C2H2和C4H6 |
| D、正戊烷和2一甲基丁烷 |
室温,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
下列实验推理中,正确的是( )
| A、实验时剩余的药品不能放回原瓶,所以实验时剩余的金属钠也不能放回原瓶 |
| B、某种气体通入品红溶液中,品红褪色,该气体一定是SO2 |
| C、焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素 |
| D、将铜片放入浓硫酸中,无明显现象,说明铜在冷浓硫酸中发生钝化 |
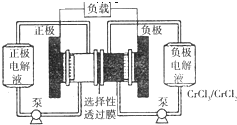 铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ | 放电 |
| 充电 |
| A、电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D、电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol?L-1 |
下列说法中正确的是( )
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| C、熵增加且吸热的反应一定是自发反应 |
| D、恒压条件下,反应的热效应等于焓变 |
下列物质属于电解质的是( )
| A、NaCl溶液 |
| B、熔融BaDO4 |
| C、NH3 |
| D、蔗糖 |