题目内容
下列说法中正确的是( )
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| C、熵增加且吸热的反应一定是自发反应 |
| D、恒压条件下,反应的热效应等于焓变 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:△H-T△S<0的反应能够自发进行,反应能否自发进行决定于焓变和熵变两方面因素,在恒压条件下,△H(焓变)数值上等于恒压反应热,反应热和焓变的单位都是kJ?mol-1.
解答:
解:A、放热的熵减小的反应在高温下不能自发进行,故A错误;
B、熵减小的放热反应,在低温下可以自发进行,故B错误;
C、熵增加且放热的反应一定能够自发进行,熵增加且吸热的反应在低温下不能自发进行,故C错误;
D、在恒压条件下,△H(焓变)数值上等于恒压反应热,故D正确.
故选D.
B、熵减小的放热反应,在低温下可以自发进行,故B错误;
C、熵增加且放热的反应一定能够自发进行,熵增加且吸热的反应在低温下不能自发进行,故C错误;
D、在恒压条件下,△H(焓变)数值上等于恒压反应热,故D正确.
故选D.
点评:本题考查了反应自发进行的条件以及焓变与反应热的关系,题目难度不大.

练习册系列答案
相关题目
目前,科学家正在研究开发一种高能电池--钠硫电池,它以熔融钠、硫为两极,以导电的β-A2lO3陶瓷作固体电解质,反应式如下:Na2SX
2Na+xS以下说法正确的是( )
| ||
| 放电 |
| A、放电时,Na作正极,S极发生还原反应 |
| B、放电时,Na发生还原反应 |
| C、充电时,钠极与外电源的正极相连 |
| D、充电时,阳极发生的反应为:SX2--2e=xS |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+.Ag+.Na+.Cl- |
| B、K+.Na+.NO3-.CO32- |
| C、Na+.H+.NO3-.SO42- |
| D、Fe3+.Na+.Cl-. SO42- |
下列说法正确的是( )
| A、离子化合物中可能含有共价键 |
| B、极性分子中不含有非极性键 |
| C、非极性分子一定含有有非极性键 |
| D、共价化合物中可能含有含有离子键 |
下列对于Fe(OH)3胶体的说法正确的是( )
| A、当光束通过Fe(OH)3胶体时会产生丁达尔效应 |
| B、由于Fe(OH)3胶体能够吸附氢离子带正电,因此在外加电场的作用下会发生电泳现象 |
| C、Fe(OH)3胶粒做布朗运动是其能够稳定存在的唯一原因 |
| D、向Fe(OH)3胶体中加入稀硫酸出现的现象是体系颜色立即由红褐色变为黄绿色 |
下列化学用语中,书写或说法正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、乙醇含有的官能团是-OH,带一个单位负电荷 |
C、丙烷的球棍模型为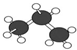 |
| D、乙酸的分子式:C2H4O |
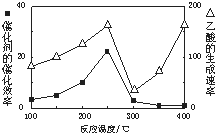 CH4和CO2反应可以制造价值更高的化学产品.
CH4和CO2反应可以制造价值更高的化学产品.