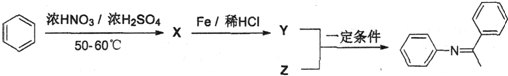
题目内容
15.在常温下,下列四种溶液:①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3•H2O
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是NH4++H2O?NH3•H2O+H+ (用离子方程式表示)
(2)在上述四种溶液中,pH最小的是③;c(NH4+)最小的是④ (填序号)
(3)比较溶液②、③中c(NH4+)的大小关系是②<③(填“>”、“<”或“=”)
(4)测得等体积的①④混合液pH>7中,说明NH4Cl的水解<(填“>”、“<”或“=”) NH3•H2O的电离.
分析 (1)①0.1mol/L NH4Cl 溶液中铵根离子水解溶液显酸性;
(2)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,②0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解程度相近溶液呈中性,③0.1mol/L NH4HSO4 溶液电离出氢离子溶液显酸性,④0.1mol/L NH3•H2O 溶液中一水合氨电离溶液显碱性;
(3)②0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解程度相近溶液呈中性,③0.1mol/L NH4HSO4 溶液电离出氢离子溶液显酸性抑制铵根离子的水解;
(4)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,④0.1mol/L NH3•H2O 溶液中一水合氨电离溶液显碱性.
解答 解:(1)①0.1mol/L NH4Cl 溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,②0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解程度相近溶液呈中性,③0.1mol/L NH4HSO4 溶液电离出氢离子溶液显酸性,④0.1mol/L NH3•H2O 溶液中一水合氨电离溶液显碱性,溶液PH顺序为:④>②>①>③,pH最小的是③,溶液中铵根离子浓度大小为:③>①>②>④,铵根离子浓度最小的是④,
故答案为:故③、④;
(3)②0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解相互促进,水解程度相近溶液呈中性,③0.1mol/L NH4HSO4 溶液电离出氢离子溶液显酸性抑制铵根离子的水解,②、③中c(NH4+)的大小关系是②<③,
故答案为:<;
(4)①0.1mol/L NH4Cl溶液中铵根离子水解溶液显酸性,④0.1mol/L NH3•H2O 溶液中一水合氨电离溶液显碱性,测得等体积的①④混合液pH>7,说明一水合氨电离程度大于铵根离子水解程度,
故答案为:<.
点评 本题考查了盐类水解的原理、弱电解质电离平衡的影响因素分析,溶液酸碱性和离子浓度大小比较,题目难度中等.

| A. | 盐酸 | B. | 乙醇溶液 | C. | 氯化钠溶液 | D. | Fe(OH)3胶体 |
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |
| A. | 酸性 | B. | 氧化性 | C. | 还原性 | D. | 漂白性 |
| A. | 二氧化碳 | B. | 铁矿石 | C. | 石灰石 | D. | 一氧化碳 |
| A. | 某物质灼烧时,火焰颜色为黄色,则该物质为金属钠 | |
| B. | 工业制造镁粉是将镁蒸气放在氮气中冷却 | |
| C. | 钠的化学性质很活泼,所以在自然界中只能是以游离态的形式存在 | |
| D. | 钠钾合金可以用于快中子反应堆作热交换剂 |
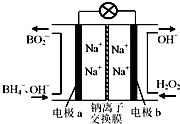 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42- | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明有Cl- | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中一定有CO32- | |
| D. | 加入氯水后,滴加KSCN溶液,溶液变红,原溶液中一定有Fe2+ |
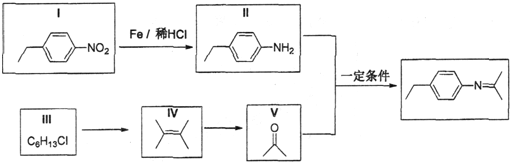

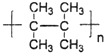
 ,Z的结构简式为
,Z的结构简式为