题目内容
7.短周期元素W、X、Y、Z的原子序数依次增大,且质子数之和为36.它们可组成离子化合物Y2X和共价化合物ZX3,已知X、Z同主族,下列说法正确的是( )| A. | 离子半径:Y>Z>X | |
| B. | 阴离子的还原性:W>Z | |
| C. | W和其他3种元素均能形成共价化合物 | |
| D. | X、Y、Z三种元素组成的化合物水溶液一定显碱性 |
分析 已知X、Z同主族,能形成共价化合物ZX3,所以X是氧元素,Z是硫元素,它们可组成离子化合物Y2X,所以Y是第ⅠA原子序数大于氧的钠,而质子数之和为36,所以W的质子数为:36-8-11-16=1,所以W是氢元素,由此分析解答.
解答 解:A、电子层数越多离子半径越大,电子层数相同,核电荷数越多半径越小,所以半径的大小为:Z>X>Y,故A错误;
B、氢负离子具有极强的还原性,远强于硫离子,所以还原性W>Z,故B正确;
C、氢与钠只能形成离子化合物氢化钠,故C错误;
D、X、Y、Z三种元素组成的化合物硫酸钠的水溶液呈中性,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,侧重于物质的性质的递变规律的考查,根据原子结构明确元素的种类为解答该题的关键.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 沸点得到小:HI>HBr>HCl>HF | |
| B. | 干冰升华克服的是分子间作用力 | |
| C. | HF稳定性很强,是因为分子间能形成氢键 | |
| D. | 冰、水和水蒸气中都存在氢键 |
12.25℃时某0.1mol/L的一元弱酸(用HA表示),未电离的弱酸分子(HA)的物质的量与电离生成的阴、阳离子总物质的量之比为4.5:1,则此溶液( )
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |
19.在相同温度下,体积相等且pH均等于3的盐酸和醋酸溶液,分别加蒸馏水稀释100倍后,下列分析中正确的是( )
| A. | 二者的pH仍然相等且均为5 | B. | 盐酸的pH大 | ||
| C. | 醋酸的pH大 | D. | 盐酸的pH为5,醋酸的pH在3~5之间 |

 .
.
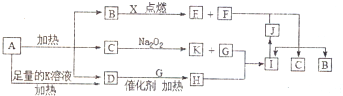
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.