题目内容
Na2CO3的摩尔质量是 ; 0.1molCO2的质量是 ,它在标准状况下的体积约为 ;在0.5L 0.2mol?L-1的 Ba(NO3)2溶液中NO3-的物质的量浓度为 .
考点:物质的量的相关计算
专题:计算题
分析:摩尔质量在数值上等于相对分子质量,结合n=
=
计算.
| m |
| M |
| V |
| Vm |
解答:
解:Na2CO3的摩尔质量是106g/mol,
m(CO2)=0.1mol×106g/mol=10.6g,
V(CO2)=0.1mol×22.4L/mol=2.24L,
在0.5L 0.2mol?L-1的 Ba(NO3)2溶液中NO3-的物质的量浓度为Ba(NO3)2的2倍,为0.4mol/L,
故答案为:106g/mol; 4.4g;2.24 L; 0.4mol/L.
m(CO2)=0.1mol×106g/mol=10.6g,
V(CO2)=0.1mol×22.4L/mol=2.24L,
在0.5L 0.2mol?L-1的 Ba(NO3)2溶液中NO3-的物质的量浓度为Ba(NO3)2的2倍,为0.4mol/L,
故答案为:106g/mol; 4.4g;2.24 L; 0.4mol/L.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
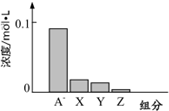 常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:
常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题: 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.