题目内容
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1的NH4Cl溶液C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液中:C(NH4+)=2 C(SO42-) |
| C、0.2mol?L-1的Na2CO3溶液中:C(OH-)=C(HCO3-)+C(H+)+C(H2CO3) |
| D、C(NH4+)相等的NH4HSO4溶液,NH4HCO3溶液和NH4Cl溶液中,C(NH4H SO4)<C( NH4Cl)<C(NH4HCO3) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性;
B.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性,溶液中存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
D.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,铵根离子水解程度越大,C(NH4+)相等的铵盐浓度越大.
B.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性,溶液中存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
D.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,铵根离子水解程度越大,C(NH4+)相等的铵盐浓度越大.
解答:
解:A.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性,所以C(OH-)<C(H+),故A错误;
B.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性,所以C(OH-)<C(H+),溶液中存在电荷守恒,根据电荷守恒得C(NH4+)+C(H+)=2 C(SO42-)+C(OH-),所以C(NH4+)<2 C(SO42-),故B错误;
C.任何电解质溶液中都存在质子守恒,根据质子守恒得C(OH-)=C(HCO3-)+C(H+)+2C(H2CO3),故C错误;
D.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,铵根离子水解程度越大,C(NH4+)相等的铵盐浓度越大,所以存在C(NH4HSO4)<C(NH4Cl)<C(NH4HCO3),故D正确;
故选D.
B.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈弱酸性,所以C(OH-)<C(H+),溶液中存在电荷守恒,根据电荷守恒得C(NH4+)+C(H+)=2 C(SO42-)+C(OH-),所以C(NH4+)<2 C(SO42-),故B错误;
C.任何电解质溶液中都存在质子守恒,根据质子守恒得C(OH-)=C(HCO3-)+C(H+)+2C(H2CO3),故C错误;
D.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,铵根离子水解程度越大,C(NH4+)相等的铵盐浓度越大,所以存在C(NH4HSO4)<C(NH4Cl)<C(NH4HCO3),故D正确;
故选D.
点评:本题考查离子浓度大小比较,根据组成盐的酸碱相对强弱确定溶液酸碱性,知道任何电解质溶液中都存在电荷守恒和物料守恒,题目难度不大.

练习册系列答案
相关题目
下列关于有机物 的说法,正确的是( )
的说法,正确的是( )
 的说法,正确的是( )
的说法,正确的是( )| A、该有机物分子中含有氯原子、羟基、羧基等官能团 |
| B、该有机物可与浓溴水发生加成反应,但不能发取代去反应 |
| C、该有机物在酸性条件下水解,生成的有机物只有两种 |
| D、1mol该化合物最多可与10molNaOH反应 |
 在25mL 0.1mol/L的NaOH溶液中逐滴加入0.2mol/L的CH3COOH溶液,溶液pH变化曲线如图所示.下列叙述中正确的是( )
在25mL 0.1mol/L的NaOH溶液中逐滴加入0.2mol/L的CH3COOH溶液,溶液pH变化曲线如图所示.下列叙述中正确的是( )| A、25℃时,A点溶液中水电离出的C(OH-)=0.1 mol/L |
| B、B点时NaOH溶液与CH3COOH溶液恰好完全反应 |
| C、C点时,溶液中离子浓度由大到小的顺序是:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、在D点时,溶液中C(CH3COO-)+C(CH3COOH)═2C(Na+) |
研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
| A、硫化氢通入浓H2SO4中 |
| B、稀H2SO4和乙酸乙酯共热 |
| C、浓H2SO4和C2H5OH共热到170℃ |
| D、潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
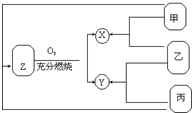 有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问:
有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问: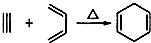 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.