题目内容
将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有( )
| A、所得溶液中c(Ag+)×c(Cl-)>Ksp(AgCl) |
| B、所得溶液中形成了更难电离的物质 |
| C、上述实验说明Cl-与NH4+间有很强的结合力 |
| D、上述过程中NH3?H2O的电离程度增大 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:氯化银能和氨水反应生成银氨溶液,银铵溶液比氯化银更难电离,据此分析即可.
解答:
解:氯化银能和氨水反应生成无色银氨溶液溶液实质为:AgCl+2NH3=Ag(NH3)2++Cl-,即生成的物质比氯化银更难电离,故选B.
点评:本题主要考查了沉淀的溶解平衡以及沉淀的转化,抓住沉淀转化的本质是解题的关键,难度中等.

练习册系列答案
相关题目
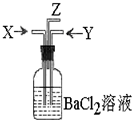 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
下列说法不正确的是( )
| A、某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n |
| B、一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积 |
| C、某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高 |
海洋中有丰富的食品、矿产、能源和药物.如图是从海水中提取某些原料的流程图.下列有关说法正确的是( )


| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、第②步属于物理变化 |
| C、从第④~⑤步的目的是浓缩、富集溴单质 |
| D、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2 固体的量减少,须加入少量的( )
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |
家用炒菜锅用水清洗后,出现红棕色的锈斑.在此变化过程中不发生的化学反应是( )
| A、4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
| B、2Fe+2H2O+O2═2Fe(OH)2 |
| C、正极反应:2H2O+O2+4 e-→4OH- |
| D、负极反应:Fe→Fe3++3 e- |
下列化合物属于弱电解质的是( )
| A、醋酸 |
| B、Ba(OH)2 |
| C、CO2 |
| D、HF |
