题目内容
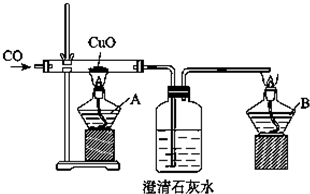
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
| 气体 | a | b | c |  | |
| A | NH3 | 浓氨水 | 氧化钙 | 浓硫酸 | |
| B | SO2 | 浓硫酸 | Cu | 酸性高锰酸钾溶液 | |
| C | O2 | 双氧水 | 二氧化锰 | 碱石灰 | |
| D | CO2 | 稀盐酸 | CaCO3 | 饱和NaHCO3溶液 |
| A、A | B、B | C、C | D、D |
考点:实验装置综合
专题:实验设计题
分析:由实验装置图可知,该装置为液体与固体(或液体)在不加热条件下反应生成气体的制备装置,并且生成的气体密度大于空气,采用用向上排空法收集,再进一步考虑题中要注意气体的净化是否合理.
解答:
解:A、氨气密度比空气小,不能用向上排空法收集,氨气能与浓硫酸反应,不能用浓硫酸净化,故A错误;
B、浓硫酸与金属铜的反应需在加热的条件下进行,而本实验没有加热,而且二氧化硫能被高锰酸钾氧化,故B错误;
C、双氧水在二氧化锰催化作用下分解生成氧气,碱石灰为固体干燥剂应该盛放在干燥管中,图中洗气装置为洗气瓶,故C错误;
D、盐酸与碳酸钠在常温下发生反应反应生成二氧化碳,浓硫酸作干燥剂干燥二氧化碳,并且二氧化碳密度大于空气,可用向上排空法收集,故D正确.
故选:D.
B、浓硫酸与金属铜的反应需在加热的条件下进行,而本实验没有加热,而且二氧化硫能被高锰酸钾氧化,故B错误;
C、双氧水在二氧化锰催化作用下分解生成氧气,碱石灰为固体干燥剂应该盛放在干燥管中,图中洗气装置为洗气瓶,故C错误;
D、盐酸与碳酸钠在常温下发生反应反应生成二氧化碳,浓硫酸作干燥剂干燥二氧化碳,并且二氧化碳密度大于空气,可用向上排空法收集,故D正确.
故选:D.
点评:本题考查气体的制备、净化和收集,题目难度不大,注意根据题目要求结合物质的性质进行解答,注意基础知识的积累.

练习册系列答案
相关题目
标准状况下的28L NH3溶于125mL水中,若所得氨水的密度近似为1g?cm-3,则下列说法正确的是( )
A、物质的量浓度(mol?L-1)与溶液质量分数、密度(g?cm-3)的关系为:c=
| ||
| B、此氨水中NH3的物质的量浓度近似为9.9 mol?L-1 | ||
| C、此氨水中NH3的物质的量浓度近似为8.55 mol?L-1 | ||
| D、此氨水中NH3的质量分数为0.17 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol?L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol?L-1.若在5mL含有KCl和KI各为0.01mol?L-1的溶液中,加入8mL 0.01mol?L-1 AgNO3溶液(已知Ksp(AgI)=1.23×10-8mol2?L-2,Ksp(AgCl)=1.25×10-5 mol2?L-2),下列叙述正确的是( )
A、混合溶液中c(K+)>c(NO
| ||
B、混合溶液中c(K+)>c(NO
| ||
| C、加入AgNO3溶液时首先生成AgCl沉淀 | ||
D、混合溶液中
|
下列说法正确的是( )
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
| A、①②③④⑤ | B、② |
| C、①③④⑤ | D、①②⑤ |
将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有( )
| A、所得溶液中c(Ag+)×c(Cl-)>Ksp(AgCl) |
| B、所得溶液中形成了更难电离的物质 |
| C、上述实验说明Cl-与NH4+间有很强的结合力 |
| D、上述过程中NH3?H2O的电离程度增大 |
某混合气体是由HF、(HF)2、(HF)3三种气体组成,该混合气体的平均相对分子质量为38,则混合气体中HF的体积分数为( )
| A、大于10% | B、小于10% |
| C、等于10% | D、无法计算 |