题目内容
20.已知A是一种气态烃.完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.A的相对分子质量小于30.在下图变化中,中间产物C跟葡萄糖一样也能和新制的氢氧化铜反应生成砖红色沉淀.(反应条件未写出)
又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.请回答下列问题:
(1)写出A的电子式
 .
.(2)B、D分子内含有的官能团分别是羟基、羧基(填名称).
(3)写出下列反应的反应类型:①加成反应,④取代反应或酯化反应.
(4)写出下列反应的化学方程式:
①CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;④CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 A是一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.则C、H原子个数比是1:2,所以最简式是CH2,最简式的式量是14,A的相对分子质量小于30,则A是CH2=CH2;A与水发生加成反应生成B为CH3CH2OH;B被催化氧化产生C为CH3CHO;C被催化氧化产生D为CH3COOH;乙醇与乙酸发生酯化反应产生乙酸乙酯CH3COOCH2CH3,据此分析解答.
解答 解:A是一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.则C、H原子个数比是1:2,所以最简式是CH2,最简式的式量是14,A的相对分子质量小于30,则A是CH2=CH2;A与水发生加成反应生成B为CH3CH2OH;B被催化氧化产生C为CH3CHO;C被催化氧化产生D为CH3COOH;乙醇与乙酸发生酯化反应产生乙酸乙酯CH3COOCH2CH3,
(1)通过以上分析知,A是乙烯,其电子式为 ,故答案为:
,故答案为: ;
;
(2)B是CH3CH2OH、D为CH3COOH,则B、D中官能团分别是羟基、羧基,故答案为:羟基;羧基;
(3)通过以上分析知,①为加成反应,④为取代反应(或者酯化反应),
故答案为:加成反应;取代反应或酯化反应;
(4)①反应方程式为CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,④反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题以烯烃、醇、醛、羧酸、酯之间的转化为载体考查有机物推断,为高频考点,涉及有机物的结构、性质、反应类型、化学方程式和电子式的书写等知识点,明确常见官能团及其性质关系是解本题关键,侧重考查学生分析判断能力,根据A的最简式及相对分子质量或产物结构简式进行推断都可,题目难度不大.

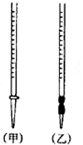 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:
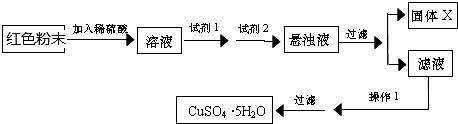
试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
| A. | 2-丁醇 | B. | 2-甲基-2丙醇 | C. | 甲醇 | D. | 2-甲基-2-丁醇 |
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
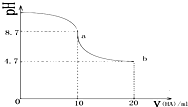
| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
| A. | 红棕色NO 2加压后颜色先变深后变浅 2NO2?N2O4 | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 | |
| D. | H2、I2、HI平衡混合气体加压后颜色变深 |