题目内容
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)容量瓶上需标有以下五项中的 ;A
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(2)配制时,其正确的操作顺序是(字母表示) ;
①用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
②用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
④将容量瓶盖紧,颠倒摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制时所需的主要实验仪器有
(4)下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
①用纸称量NaOH固体. ;
②向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施. ;
③有少量NaOH溶液残留在烧杯内. ;
④向容量瓶加水时眼睛一直俯视液面. ;
⑤配制前,容量瓶中有少量蒸馏水. ;
⑥称量NaOH时,砝码错放在左盘. .
(1)容量瓶上需标有以下五项中的
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(2)配制时,其正确的操作顺序是(字母表示)
①用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
②用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
④将容量瓶盖紧,颠倒摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制时所需的主要实验仪器有
(4)下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
①用纸称量NaOH固体.
②向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施.
③有少量NaOH溶液残留在烧杯内.
④向容量瓶加水时眼睛一直俯视液面.
⑤配制前,容量瓶中有少量蒸馏水.
⑥称量NaOH时,砝码错放在左盘.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)据容量瓶的使用方法分析,容量瓶是用来配制一定物质的量浓度溶液的定量容器,只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器.
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(3)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(3)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)根据c=
| n |
| V |
解答:
解:(1)容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量容器,容量瓶上标有容量、刻度线,则③⑤正确;
容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器,则①正确,故选:①③⑤,
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(3)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(4)①氢氧化钠固体易潮解,故用纸称量NaOH固体时,会导致真正的氢氧化钠的质量偏小,则浓度偏低,故答案为:偏低,
②向容量瓶加水定容后摇匀,发现液面低于刻度线是正常的,不采取任何措施是正确的,对浓度无影响,故答案为:无影响;
③有少量NaOH溶液残留在烧杯内,会导致溶质的损失,则浓度偏低,故答案为:偏低;
④向容量瓶加水时眼睛一直俯视液面,则导致溶液体积偏小,浓度偏高,故答案为:偏高;
⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
⑥用托盘天平称量固体时,正确的称量方法是左物右码,如果砝码错放在左盘,此时m物=m砝-m游,称量出的物品的质量偏小,则浓度偏低,故答案为:偏低.
容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器,则①正确,故选:①③⑤,
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(3)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(4)①氢氧化钠固体易潮解,故用纸称量NaOH固体时,会导致真正的氢氧化钠的质量偏小,则浓度偏低,故答案为:偏低,
②向容量瓶加水定容后摇匀,发现液面低于刻度线是正常的,不采取任何措施是正确的,对浓度无影响,故答案为:无影响;
③有少量NaOH溶液残留在烧杯内,会导致溶质的损失,则浓度偏低,故答案为:偏低;
④向容量瓶加水时眼睛一直俯视液面,则导致溶液体积偏小,浓度偏高,故答案为:偏高;
⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
⑥用托盘天平称量固体时,正确的称量方法是左物右码,如果砝码错放在左盘,此时m物=m砝-m游,称量出的物品的质量偏小,则浓度偏低,故答案为:偏低.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
元素A的最高正价和负价的绝对值之差为6,则A元素可能形成的化合物是( )
| A、MgF2 |
| B、CaCl2 |
| C、K2S |
| D、Na2O |
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Cu) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
下列过程与配合物的形成无关的是( )
| A、向一定量的AgNO3溶液中加入氨水至沉淀消失 |
| B、向FeCl3溶液中加入KSCN溶液 |
| C、向一定量的CuSO4溶液中加入氨水至沉淀消失 |
| D、除去铁粉中的铝粉可以用强碱溶液 |
为确定某溶液的离子组成,进行实验:根据以上实验,以下对原溶液的推测正确的是( )
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定有CO32-离子存在 |
| B、不能确定是否存在HCO3-离子存在 |
| C、一定有C1-离子存在 |
| D、一定有SO32-离子存在 |
HA为酸性略强于醋酸的一元弱酸.在0.1mol?L-1 NaA溶液中,离子浓度关系正确的是( )
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(H+)=c(A-)+c(OH-) |
| D、c(Na+)+c(OH-)=c(A-)+c(H+) |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:
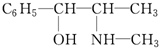 麻黄素中含氧官能团的名称是
麻黄素中含氧官能团的名称是