题目内容
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如表所示,请回答:
(1)三次检测结果中第 次检测结果不正确.
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加 溶液(填化学式),其目的是 .第二,继续加入过量的该溶液,其目的是 .
第三,再向溶液中加入 溶液(填化学式),确定 离子的存在,其离子反应方程式为 .
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加
第三,再向溶液中加入
考点:几组未知物的检验
专题:物质检验鉴别题
分析:(1)第二次检出物质中,明显存在不共存的离子组,即:硫酸根与钡离子;
(2)检验硫酸根之前应先检验碳酸根的存在,即排除碳酸根干扰后再验证硫酸根的存在.
(2)检验硫酸根之前应先检验碳酸根的存在,即排除碳酸根干扰后再验证硫酸根的存在.
解答:
解:(1)由于氯化钡与硫酸钠能生成白色难溶于水的硫酸钡沉淀,故第二组检验结果不正确,故答案为:二;
(2)向溶液中加入稀HNO3,若有无色气体放出,则证明含有CO32-,继续向该溶液中滴加稀硝酸除去CO32-后,再加入BaCl2溶液,用来验证SO42-的存在,钡离子与硫酸根反应生成硫酸钡沉淀,反应的离子反应方程式为:Ba2++SO42-═BaSO4↓,故答案为:稀HNO3;检验CO32-;除去CO32-;BaCl2 ;SO42-;Ba2++SO42-═BaSO4↓.
(2)向溶液中加入稀HNO3,若有无色气体放出,则证明含有CO32-,继续向该溶液中滴加稀硝酸除去CO32-后,再加入BaCl2溶液,用来验证SO42-的存在,钡离子与硫酸根反应生成硫酸钡沉淀,反应的离子反应方程式为:Ba2++SO42-═BaSO4↓,故答案为:稀HNO3;检验CO32-;除去CO32-;BaCl2 ;SO42-;Ba2++SO42-═BaSO4↓.
点评:本题主要考查的是溶液中离子存在的检验,在检验离子是否存在时,应首先排除干扰离子,属于中等题.

练习册系列答案
相关题目
R2O8n-离子在一定条件下可以把Mn2-氧化为MnO4,若反应后R2O8n-离子变为RO42离子,知反应中氧化剂与还原剂的离子数之比为5:2,则R2O8n-离子中R元素的化合价以及n值分别为( )
| A、+7、2 | B、+6、2 |
| C、+5、1 | D、+4、1 |
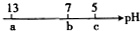 已知二元含氧酸H2X易溶于水,向1.0mol?L-1 的酸式盐NaHX中滴入几滴石蕊试剂,溶液变红.下列说法错误的是( )
已知二元含氧酸H2X易溶于水,向1.0mol?L-1 的酸式盐NaHX中滴入几滴石蕊试剂,溶液变红.下列说法错误的是( )| A、NaHX溶液呈酸性 |
| B、若上述溶液中检测不到HX-,则NaHX溶于水时的电离方程式为:NaHX=Na++H++X- |
| C、若上述溶液中检测不到H2X,但能检测到HX-,则NaHX溶于水时,水的电离程度增大 |
| D、若上述溶液中能检测到H2X,则此时溶液中c(X2-)>c(H2X) |
将NaCl和NaBr的混合物mg,溶于足量的水配成500mL溶液A,再向其中通入足量的Cl2,充分反应后将溶液蒸干,得固体(m-2)g,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能是( )
| A、3:2:1 |
| B、3:1:2 |
| C、4:3:2 |
| D、5:1:4 |
下列物质能导电,且为电解质的是( )
| A、蔗糖 |
| B、KNO3晶体 |
| C、盐酸 |
| D、熔化的NaCl |
 对如图中两极加以必要的连接并填空:
对如图中两极加以必要的连接并填空: