题目内容
1.下列关于化学键的说法中不正确的是( )| A. | 化学键是一种作用力 | |
| B. | 化学键可以使原子相结合,也可以使离子相结合 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 | |
| D. | 极性键不是一种化学键 |
分析 A.化学键是相邻原子之间强烈的相互作用;
B.形成化学键的微粒可能是阴阳离子或原子;
C.化学反应的实质是有旧化学键的断裂和新化学键的形成;
D.共价键分为极性键和非极性键.
解答 解:A.化学键是相邻原子之间强烈的相互作用,所以化学键是一种作用力,故A正确;
B.形成化学键的微粒可能是阴阳离子或原子,所以化学键可以使离子相结合,也可以使原子相结合,故B正确;
C.化学反应的实质是有旧化学键的断裂和新化学键的形成,所以化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成,故C正确;
D.共价键分为极性键和非极性键,所以极性键是一种化学键,故D错误;
故选D.
点评 本题考查化学键,侧重考查基本概念,题目难度不大,侧重于考查学生的分析能力和应用能力,注意把握共价键的分类和化学反应的实质.

练习册系列答案
相关题目
11.可逆反应N2+3H2$?_{催化剂}^{高温高压}$2NH3,在体积不变的密闭容器中反应,达到平衡状态的标志是( )
| A. | 单位时间内生成n molN2的同时生成n molNH3 | |
| B. | N2、H2、NH3的物质的量浓度比值为1:3:2 | |
| C. | v(N2)=v(NH3) | |
| D. | 单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键 |
12.已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸,下列有关氮化镓的说法中正确的是( )
| A. | 氮化镓是由主族元素与副族元素形成的化合物 | |
| B. | 镓元素比铝元素金属性弱 | |
| C. | 氮化镓中氮元素显+3价 | |
| D. | 氮原子最外层比镓原子最外层多2个电子 |
9.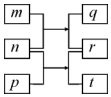 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W>X>Y | B. | 元素的非金属性Z>X>Y | ||
| C. | X的氢化物常温常压下为液态 | D. | Y的最高价氧化物的水化物为弱酸 |
6.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱:S>C | |
| D. | F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl |
13.0.1mol•L-1K2CO3溶液中下列表达式不正确的是( )
| A. | c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+) | |
| B. | c(K+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1 | |
| D. | c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-) |
5.真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=1344.1kJ•mol-1
②2AlCl3(g)=2Al(s)+3Cl2(g)△H2=1169.2kJ•mol-1
③Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H3=Q kJ•mol-1
下列有关说法正确的是( )
①Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=1344.1kJ•mol-1
②2AlCl3(g)=2Al(s)+3Cl2(g)△H2=1169.2kJ•mol-1
③Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H3=Q kJ•mol-1
下列有关说法正确的是( )
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有AlCl3 |
6.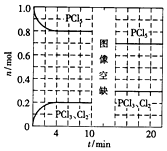 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)═PCl3(g)+Cl2(g)△H=akJ/mol(a>0)0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示.下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:PCl5(g)═PCl3(g)+Cl2(g)△H=akJ/mol(a>0)0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示.下列说法正确的是( )
| A. | 0~4min的平均速率v(Cl2)=0.05mol/(L•min ) | |
| B. | 10min时改变的条件是分离出一定量的PCl5 | |
| C. | 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ | |
| D. | 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆) |
