题目内容
11.可逆反应N2+3H2$?_{催化剂}^{高温高压}$2NH3,在体积不变的密闭容器中反应,达到平衡状态的标志是( )| A. | 单位时间内生成n molN2的同时生成n molNH3 | |
| B. | N2、H2、NH3的物质的量浓度比值为1:3:2 | |
| C. | v(N2)=v(NH3) | |
| D. | 单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,且反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.单位时间内生成n molN2的同时生成n molNH3,同时消耗0.5nmolN2,正逆反应速率不相等,反应没有达到平衡状态,故A错误;
B.N2、H2、NH3的物质的量浓度比值为1:3:2,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始浓度及转化率有关,故B错误;
C.v(N2)=v(NH3)时,表示的是反应速率,但是不满足二者的化学计量数关系且没有明确正逆反应,不能说明达到平衡状态,故C错误;
D.单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键,同时生成1mol氮氮键,正逆反应速率相等,反应达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,D为易错点,注意化学键断裂情况与对应反应物之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.对于合成氨反应,达到平衡后,以下分析正确的是( )
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
2.分子式为C6H14O且含有“-CH2OH”的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8 种 | C. | 9 种 | D. | 10种 |
19.下列物质的分离方法的原理与溶解度不相关的是( )
| A. | 蒸馏分馏 | B. | 重结晶法 | C. | 纸层析法 | D. | 萃取分液 |
6.下列反应中,不属于可逆反应的是( )
| A. | Cl2与水反应 | |
| B. | 水电解生成H2 和H2在O2中燃烧生成水的相互转化过程 | |
| C. | 工业合成氨 | |
| D. | 氨气与水反应 |
16. 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于由非极性键构成的极性分子 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同位素 |
3.下列叙述中正确的是( )
| A. | 只有活泼金属与活泼非金属之间才能形成离子键 | |
| B. | 具有共价键的化合物是共价化合物 | |
| C. | 化学键是分子中多个原子之间强烈的相互作用 | |
| D. | 具有离子键的化合物是离子化合物 |
20.一定条件下,某容器中各微粒在反应前后变化的示意图如下:(其中●代表氧原子,○代表硫原子)
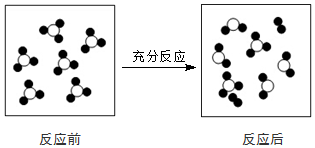
关于此反应说法错误的是( )

关于此反应说法错误的是( )
| A. | 一定属于分解反应 | B. | 一定属于氧化还原反应 | ||
| C. | 一定属于放热反应 | D. | 一定属于可逆反应 |
1.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使原子相结合,也可以使离子相结合 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 | |
| D. | 极性键不是一种化学键 |