题目内容
13.0.1mol•L-1K2CO3溶液中下列表达式不正确的是( )| A. | c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+) | |
| B. | c(K+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1 | |
| D. | c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-) |
分析 K2CO3为强碱弱酸盐,CO32-水解显碱性,且水解分步进行,溶液中遵循电荷守恒、物料守恒,以此来解答.
解答 解:A.CO32-水解显碱性,且水解分步进行,可知离子浓度为c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+),故A正确;
B.由电荷守恒可知,c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B错误;
C.0.1mol•L-1K2CO3溶液中,由物料守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1,故C正确;
D.由c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(K+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)],可知c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-),故D正确;
故选B.
点评 本题考查离子浓度的比较,为高频考点,把握电荷守恒及物料守恒为解答的关键,侧重分析与应用能力的考查,注意水解原理的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列叙述中正确的是( )
| A. | 只有活泼金属与活泼非金属之间才能形成离子键 | |
| B. | 具有共价键的化合物是共价化合物 | |
| C. | 化学键是分子中多个原子之间强烈的相互作用 | |
| D. | 具有离子键的化合物是离子化合物 |
1.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使原子相结合,也可以使离子相结合 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 | |
| D. | 极性键不是一种化学键 |
18.化学与生产、生活密切相关.下列有关叙述正确的是( )
| A. | 大气雾霾污染现象的产生与汽车尾气排放有关 | |
| B. | 玻璃和氮化硅陶瓷都属于新型无机非金属材料 | |
| C. | 活性炭与二氧化硫都可用于漂白,其漂白原理相同 | |
| D. | 空气中的臭氧对人体健康有益无害 |
17.在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=-122.5kJ•mol-1
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如表:
则达到平衡时CO的转化率为45%.
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图1所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.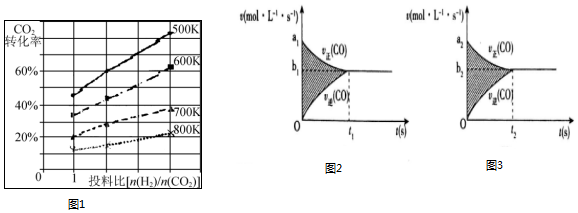
(4)反应③的v-t图象如图2所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图象如图3所示.
下列说法正确的是D
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦t1<t2⑧两图中阴影部分面积相等 ⑨右图阴影部分面积更大⑩左图阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=-122.5kJ•mol-1
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图1所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.

(4)反应③的v-t图象如图2所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图象如图3所示.
下列说法正确的是D
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦t1<t2⑧两图中阴影部分面积相等 ⑨右图阴影部分面积更大⑩左图阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
18.元素是构成我们生活的世界中一切物质的“原材料”.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
上述科学家的研究按照时间先后排序合理的是②③④①(填数字序号).
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.
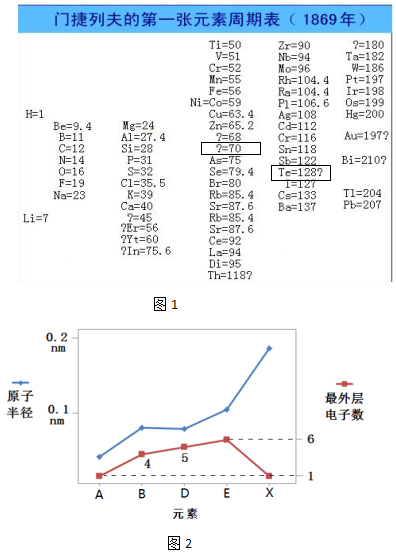
①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.

①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
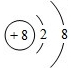 .
. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.