题目内容
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
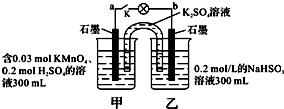

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:图中装置为原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题.
解答:
解:A.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1022个电子转移时,即0.02mol电子转移时,乙中生成0.03molH+,c(H+)=
=0.1mol/L,则pH=1,故A正确;
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,外电路的电子方向是从b(负极)到a(正极),故B正确;
C.电池工作时,甲烧杯中电极方程式为2MnO4-+16H++10e-=2Mn2++8H2O,反应消耗H+,硫酸浓度降低,则水电离出的c(H+)逐渐增大,故C错误;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确.
故选C.
| 0.03mol |
| 0.3L |
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,外电路的电子方向是从b(负极)到a(正极),故B正确;
C.电池工作时,甲烧杯中电极方程式为2MnO4-+16H++10e-=2Mn2++8H2O,反应消耗H+,硫酸浓度降低,则水电离出的c(H+)逐渐增大,故C错误;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确.
故选C.
点评:本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度总等.

练习册系列答案
相关题目
一种以2mol?L Na2SO4水溶液为电解质的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4
Na3Ti2(PO4)3+ZnSO4其中P的化合价为+5,下列有关说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,NaTi2(PO4)3发生氧化反应 |
| B、放电时,钠离子向负极移动 |
| C、充电时,阳极反应式为:Zn-2e-=Zn2+ |
| D、充电时,每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3 |
持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品.暖宝宝采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当( )
| A、负极 | B、正极 | C、阴极 | D、阳极 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18gD2O中含有的电子数是10NA |
| B、1molBaCl2中含有的离子数是2NA |
| C、7.1gCl2与足量的NaOH溶液反应转移的电子数是0.2NA |
| D、1molCH4分子中共价键总数是4NA |
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、上述气体检测时,敏感电极均作电池正极 |
| B、检测Cl2气体时,敏感电极的电极反应为:Cl2+2e-═2Cl- |
| C、检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- |
| D、检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
下列叙述正确的是( )
| A、某元素由化合态变成游离态,该元素一定被氧化 |
| B、卤素离子(X-)只有还原性而无氧化性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、负一价卤素离子的还原性在同一族中从上至下逐渐增强 |
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: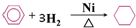 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl