题目内容
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl(1)属于弱电解质的是
(2)常温下0.01mol/L HCl溶液的pH=
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
(4)常温下,向100mL 0.01mol?L-1HA溶液逐滴加入0.02mol?L-1 MOH溶液,如图所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
②K点对应的溶液中,c(M+)+c(MOH)=
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸;
(4)①根据酸的浓度和溶液的PH判断酸的强弱;
②根据物料守恒计算.
(2)pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸;
(4)①根据酸的浓度和溶液的PH判断酸的强弱;
②根据物料守恒计算.
解答:
解:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,属于弱电解质的是一水合氨和醋酸,碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,故选:③④;②④⑤;
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:2;10-3 mol/L;
(3)醋酸是弱电解质,氯化氢是强电解质,稀释会促进醋酸的电离,若将醋酸和盐酸稀释相同的倍数,醋酸的pH会比盐酸小,因此若要使醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸要稀释的倍数要更大一点才能满足要求,故答案为:小于;
(5)①根据图象知,0.01mol?L-1HA溶液中pH=2,氢离子浓度等于酸浓度,所以该酸是强酸,故答案为:强;
②K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据M元素守恒知,c(M+)+c(MOH)=
mol/L=0.01mol/L,故答案为:0.01.
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:2;10-3 mol/L;
(3)醋酸是弱电解质,氯化氢是强电解质,稀释会促进醋酸的电离,若将醋酸和盐酸稀释相同的倍数,醋酸的pH会比盐酸小,因此若要使醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸要稀释的倍数要更大一点才能满足要求,故答案为:小于;
(5)①根据图象知,0.01mol?L-1HA溶液中pH=2,氢离子浓度等于酸浓度,所以该酸是强酸,故答案为:强;
②K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据M元素守恒知,c(M+)+c(MOH)=
| 0.002 |
| 0.2 |
点评:本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质电离特点及酸碱中和反应来分析解答,明确物质的性质是解本题关键,再结合基本概念、pH的计算、物料守恒等知识点分析,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、由2H和18O组成的水11 g,所含的中子数为4NA |
| B、标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA |
| C、在0.1 mol?L-1的醋酸溶液中,所含H+的个数小于0.1NA |
| D、室温下H2O2分解得到16 g O2,转移的电子数为2NA |
隆冬季节,雾霾天气增多造成一些城市空气重度污染,其中的污染物不包括( )
| A、PM2.5 |
| B、NO2 |
| C、SO2 |
| D、CO2 |
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
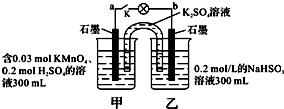

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
某研究小组用新颖的NaBH4/H2O2燃料电池模拟电化学降解NO3-,下列说法不正确的是( )


| A、图1电池放电过程中,Na+从负极区向正极区迁移 |
| B、图1电池负极区的电极反应为:BH4--8e-+8OH-═BO2-+6H2O |
| C、图2中若电解过程中转移了a mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为6.2a g |
| D、图2阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题: