题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18gD2O中含有的电子数是10NA |
| B、1molBaCl2中含有的离子数是2NA |
| C、7.1gCl2与足量的NaOH溶液反应转移的电子数是0.2NA |
| D、1molCH4分子中共价键总数是4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.重水的摩尔质量为20g/mol,18g重水的物质的量为0.9mol,含有9mol电子;
B.1mol氯化钡中含有1mol钡离子、2mol氯离子,总共含有3mol离子;
C.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是氧化剂,0.1mol氯气完全反应转移了0.1mol电子;
D.甲烷中含有4个碳氢键,1mol甲烷中含有4mol共价键.
B.1mol氯化钡中含有1mol钡离子、2mol氯离子,总共含有3mol离子;
C.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是氧化剂,0.1mol氯气完全反应转移了0.1mol电子;
D.甲烷中含有4个碳氢键,1mol甲烷中含有4mol共价键.
解答:
解:A.18重水的物质的量为0.9mol,0.9mol重水含有9mol电子,含有的电子数是9NA,故A错误;
B.1mol氯化钡中含有3mol离子,含有的离子数是3NA,故B错误;
C.7.1gCl2的物质的量为0.1mol,0.1mol氯气足量的NaOH溶液反应转移了0.1mol电子,转移的电子数是0.1NA,故C错误;
D.1mol甲烷中含有4mol共价键,共价键总数是4NA,故D正确;
故选D.
B.1mol氯化钡中含有3mol离子,含有的离子数是3NA,故B错误;
C.7.1gCl2的物质的量为0.1mol,0.1mol氯气足量的NaOH溶液反应转移了0.1mol电子,转移的电子数是0.1NA,故C错误;
D.1mol甲烷中含有4mol共价键,共价键总数是4NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项C额易错点,注意氯气与氢氧化钠溶液的反应情况.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列说法正确的是( )
A、
| ||
B、 互为同分异构体 互为同分异构体 | ||
| C、正丁烷与异丁烷互为同系物 | ||
| D、32S与33S是同种核素 |
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
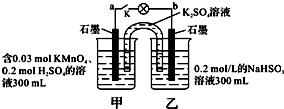

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
下列三种有机物是某些药物中的有效成分:

下列叙述正确的是( )

下列叙述正确的是( )
| A、使用FeCl3溶液和稀硫酸可以鉴别这三种有机物 |
| B、三种有机物苯环上的氢原子若被氯原子取代,其一氯代物只有二种 |
| C、将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多 |
| D、都能发生水解 |
下列有关原电池的说法中正确的是( )
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
下列既属于氧化还原反应,又属于吸热反应的是( )
| A、铝片和稀盐酸反应 |
| B、高温煅烧石灰石 |
| C、灼热的碳与二氧化碳的反应 |
| D、甲烷在氧气中的燃烧 |
下列说法不正确的是( )
| A、利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出 |
| B、用玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 |
| C、中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 |
| D、检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
