题目内容
14. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)利用反应:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O可以处理硝酸工业中产生的NO2,消除尾气污染.上述反应中,每转移1.2mol电子,消耗的NO2在标准状况下的体积是6.72L.
(2)已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
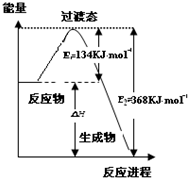
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,则E1减小(填“增大”“减小”或“不变”,下同),△H不变;
请写出反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(4)熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物作电解质,负极通入CO,正极通入空气与CO2的混合气,制得燃料电池.电池的负极反应式为CO-2e-+CO32-=2CO2;使用该电池用惰性电极电解200mL1.5mol/L的NaCl溶液,电解时两极共产生448mL气体(标准状况下),写出该电解反应的离子方程式2Cl-+2H2O═Cl2↑+H2↑+2OH;假设溶液体积不变,则电解后该溶液的pH为13.
分析 (1)反应中NO2中N元素化合价由+4降低为氮气中0价,据此计算NO2的物质的量,再根据V=nVm计算NO2的体积;
(2)根据盖斯定律计算反应热;
(3)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(4)该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子,根据电解食盐水的总反应来及计算回答,据此分析解答.
解答 解:(1)反应中NO2中N元素化合价由+4降低为氮气中0价,转移1.2mol电子时,消耗的NO2的物质的量=$\frac{1.2mol}{4}$=0.3mol,故消耗NO2的体积=0.3mol×22.4L/mol=6.72L,故答案为:6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
根据盖斯定律,(①-②)×$\frac{1}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g) 故△H=$\frac{1}{2}$×[(-196.6kJ•mol-1)-(-113.0kJ•mol-1)]=-41.8kJ•mol-1,故答案为:-41.8;
(3)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(4)该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2 CO32-,负极上燃料CO失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO+2CO32--4e-═4CO2;电解氯化钠溶液反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,根据总反应当两极上共收集到0.448L即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C=$\frac{n}{V}$=V$\frac{0.02mol}{0.2L}$=0.1mol/L,所以pH=13,
故答案为:CO-2e-+CO32-=2CO2; 2Cl-+2H2O═Cl2↑+H2↑+2OH-;13.
点评 本题考查较为综合,题目难度中等,涉及氧化还原反应计算、电化学知识、反应热计算、注意热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握.

 名校课堂系列答案
名校课堂系列答案| A. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| B. | 污水处理可采用混凝法,明矾是一种常用的混凝剂 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
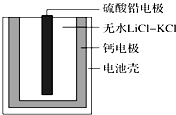 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 常温时,在正负极间接上电流表或检流计,指针发生偏转 | |
| D. | 每转移0.1 mol电子,理论上生成10.35g Pb |
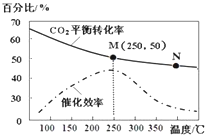
| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 化学平衡常数:KN>KM | |
| C. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 | |
| D. | 电池正极反应式为:2MnO2+2e一+2H2O═2MnO (OH)+2OH- |
 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.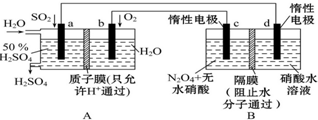 膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:
膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图: