题目内容
6. 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1,
C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJ•mol一1;
则反应:3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H=+18.7kJ•mol-1.
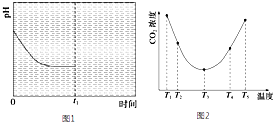
(2)目前 (NH4)2CO3已经被用作工业捕碳剂,为研究温度对(NH4)2CO3捕获CO2效率的影响,在T1温度下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、
T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①该反应的△H<0(填“>”、“=”或“<”).
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高.T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获.
③该反应在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度.请在该图中画出t1时刻后溶液的pH变化总趋势曲线.
(3)利用该反应捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有降低温,增加CO2浓度(或分压)(写出两条).
分析 (1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1,
②C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJ•mol一1;
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应的热化学方程式;
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H<0);
②T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
(3)根据平衡移动原理分析;
解答 解:(1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1,
②C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJ•mol一1;
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应:3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H=+18.7 kJ•mol-1,
故答案为:+18.7 kJ•mol-1;
(2)①由图1可知:温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H<0,
故答案为:<;
②在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小,T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获,
故答案为:T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为,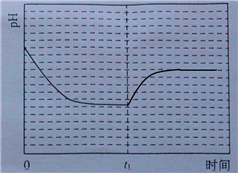 ;
;
故答案为:
(3)在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量,(NH4)2CO3(aq)+H2O(l)+CO2(g)?2(NH4)2HCO3(aq)△H<0,根据平衡移动原理,降低温度或增大c(CO2)(或分压),
故答案为:降低温度,增加CO2浓度(或分压);
点评 本题考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等,题目综合性较强,难度中等.

| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| D. | 氯化亚铁溶液中通入氯气:Cl2+2Fe2+═2Fe3++2Cl- |
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
| A. | 处理过程中银器一直保持恒重 | |
| B. | 银器为正极,Ag2S被氧化生成单质银 | |
| C. | 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色Ag |
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |



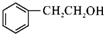 ,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为
,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为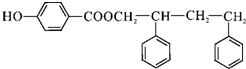 .
. ,F→G①的化学方程式为
,F→G①的化学方程式为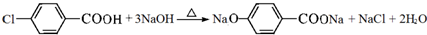 .
. .
. .
.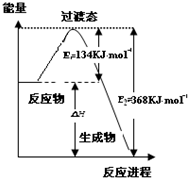 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.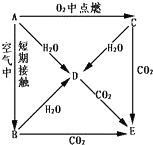 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.