题目内容
19.一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$ CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )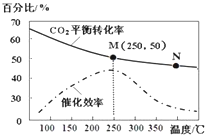
| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 化学平衡常数:KN>KM | |
| C. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
分析 A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
C、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,据此列三段式计算.
解答 解:A、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A错误;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故B错误;
C、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,但催化剂只影响反应速率,不影响平衡移动和转化率,故C错误;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故D正确;
故选D.
点评 本题考查了图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度中等.

练习册系列答案
相关题目
11.以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )
| A. | 溶液的pH变小 | B. | 阴极逸出气体 | ||
| C. | 阳极附近溶液呈蓝色 | D. | 阴极附远溶液呈红色 |
12.下面是四种元素的基态原子的电子排布式,其中化合价最高的是( )
| A. | 1s22s22p3 | B. | 1s22s22p63s23p63d34s2 | ||
| C. | 1s22s22p63s23p6 | D. | 1s22s22p5 |
7.可逆反应发生下列变化,平衡一定正向移动的是( )
| A. | 正反应速率增大 | B. | 反应物浓度减小 | ||
| C. | K值减小 | D. | 正反应速率大于逆反应速率 |
8.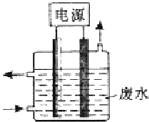 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
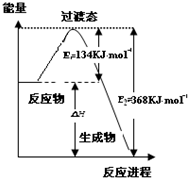 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.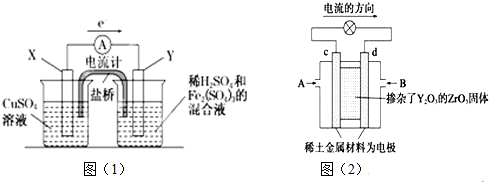
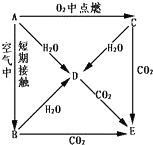 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.