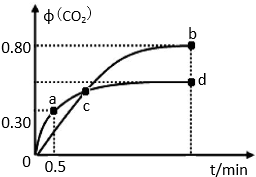
题目内容
在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍.请回答下列问题.
(1)若反应经历5min达到平衡,则Y的平均反应速率为 .
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲.
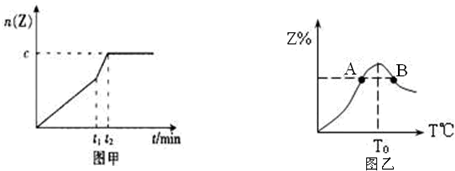
若c=0.90mol,t1时刻改变的条件是 (填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t2 5min (填“>”,“<”或“=”下同).
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量 0.9mol (填“>”,“<”或“=”).
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙.
①A、B两点Z物质正反应速率的大小关系是 ;
②温度T<T0时,Z%逐渐增大的原因是 .
(1)若反应经历5min达到平衡,则Y的平均反应速率为
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲.

若c=0.90mol,t1时刻改变的条件是
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙.
①A、B两点Z物质正反应速率的大小关系是
②温度T<T0时,Z%逐渐增大的原因是
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:依据平衡三段式列式计算,设消耗的Y物质的量为x
2X(g)+Y(g)?2Z(g)
起始量(mol) 2 1 0
变化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,2-2x+1-x+2x=(2+1)×0.85
x=0.45,
(1)依据平衡计算分析反应速率V=
计算;
(2)图象分析平衡不移动,反应速率增大,可能是使用了催化剂,达到平衡所需时间短;
(3)恒压容器中反应是气体体积减小的反应,为保持恒压体积缩小相当于平衡正向进行,Z的物质的量增大;
(4)起始时加入物质的量均为3.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,Z的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等;随着温度的继续升高,Z的物质的量分数逐渐减小,说明温度升高平衡左移;温度越高,反应速率越大;
Z%逐渐增大的原因反应还没有到达平衡,反应正向进行,随着温度升高,生成的Z越来越多.
2X(g)+Y(g)?2Z(g)
起始量(mol) 2 1 0
变化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,2-2x+1-x+2x=(2+1)×0.85
x=0.45,
(1)依据平衡计算分析反应速率V=
| △c |
| △t |
(2)图象分析平衡不移动,反应速率增大,可能是使用了催化剂,达到平衡所需时间短;
(3)恒压容器中反应是气体体积减小的反应,为保持恒压体积缩小相当于平衡正向进行,Z的物质的量增大;
(4)起始时加入物质的量均为3.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,Z的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等;随着温度的继续升高,Z的物质的量分数逐渐减小,说明温度升高平衡左移;温度越高,反应速率越大;
Z%逐渐增大的原因反应还没有到达平衡,反应正向进行,随着温度升高,生成的Z越来越多.
解答:
解:设消耗的Y物质的量为x
2X(g)+Y(g)?2Z(g)
起始量(mol) 2 1 0
变化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,2-2x+1-x+2x=(2+1)×0.85
x=0.45mol,则
(1)若反应经历5min达到平衡,则Y的平均反应速率=
=0.045mol/(L?min),故答案为:0.045mol/(L?min);
(2)若c=0.90mol,图象分析可知反应速率增大,但最后大点的平衡状态不变,反应是气体体积变化的反应,所以改变的条件是加入了催化剂的作用,t1时刻改变的条件是加入了催化剂,反应速率增大,达到平衡所需要的时间缩短,小于5min;
故答案为:E;<;
(3)若其他条件不变,原容器为恒压容器,恒压容器中反应是气体体积减小的反应,为保持恒压体积缩小相当于平衡正向进行,Z的物质的量增大达到平衡后Z的物质的量大于0.9mol;
故答案为:>;
(4)①起始时加入物质的量均为3.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,Z的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,随着温度的继续升高,Z的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,温度越高,反应速率越大,B点温度大于A点,则A点反应速率小于B点,故答案为:B>A;
②温度T<T0时,Z%逐渐增大的原因是,温度T0前,反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的Z越来越多,
故答案为:反应还没有到达平衡,反应向正反应进行,故Z%的逐渐增大.
2X(g)+Y(g)?2Z(g)
起始量(mol) 2 1 0
变化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,2-2x+1-x+2x=(2+1)×0.85
x=0.45mol,则
(1)若反应经历5min达到平衡,则Y的平均反应速率=
| ||
| 5min |
(2)若c=0.90mol,图象分析可知反应速率增大,但最后大点的平衡状态不变,反应是气体体积变化的反应,所以改变的条件是加入了催化剂的作用,t1时刻改变的条件是加入了催化剂,反应速率增大,达到平衡所需要的时间缩短,小于5min;
故答案为:E;<;
(3)若其他条件不变,原容器为恒压容器,恒压容器中反应是气体体积减小的反应,为保持恒压体积缩小相当于平衡正向进行,Z的物质的量增大达到平衡后Z的物质的量大于0.9mol;
故答案为:>;
(4)①起始时加入物质的量均为3.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,Z的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,随着温度的继续升高,Z的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,温度越高,反应速率越大,B点温度大于A点,则A点反应速率小于B点,故答案为:B>A;
②温度T<T0时,Z%逐渐增大的原因是,温度T0前,反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的Z越来越多,
故答案为:反应还没有到达平衡,反应向正反应进行,故Z%的逐渐增大.
点评:本题借助于图象考查了化学反应速率、化学平衡的标志、化学平衡计算,化学平衡的影响因素等,题目难度中等,注意反应原理的掌握.

练习册系列答案
相关题目
我国城市近年来已发布“空气质量日报”.下列物质中不列入首要污染物的是( )
| A、NO2 |
| B、SO2 |
| C、CO2 |
| D、可吸入颗粒物 |
t℃时,在2L的密闭容器中存在反应:m A(g)+n B(s)═p C(g)△H=a KJ?mol-1,已知t℃时该反应平衡常数为K,且起始加料如下表所示:下列说法正确的是( )
| A | B | C | |
| 起始加料(mol) | x | y | z |
A、若
| ||
B、若
| ||
| C、若m+n<p,且a<0,则正反应一定可以自发进行 | ||
| D、若m+n>p,则正反应方向是熵减的方向 |
下列有关化学用语的表示正确的是( )
A、NH4Cl的电子式: | ||
B、S的结构示意图: | ||
C、中子数为21的钾原子:
| ||
D、对硝基苯酚的结构简式: |
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、32 g氧气和臭氧的混合气体中所含的原子数为2N. |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、0.1mol OH-含有NA个电子 |
| D、2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA |
下列反应的能量变化与其他三项不相同的是( )
| A、铝粉与氧化铁的反应 |
| B、NH4Cl晶体与Ba(OH)2?8H2O晶体的反应 |
| C、锌片与稀硫酸反应 |
| D、钠与冷水反应 |
下列有机物只有四种同分异构体的是( )
| A、分子式为C4H10烷烃的二氯取代物 |
| B、分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连 |
| C、乙苯的二氯取代物 |
| D、分子式为C4H8的有机物 |