题目内容
12.如表中实验操作能达到实验目的是( )| 实验操作 | 实验目的 | |
| A | 向苯和苯酚混合溶液中滴加过量浓溴水 | 除去混合溶液中的苯酚 |
| B | 向待测液中加入饱和碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氢氧化钠溶液,再向其中加入0.5mL乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯酚与浓溴水反应制备三溴苯酚,三溴苯酚易溶于苯;
B.乙酸与碳酸钠反应生成气体、乙醇与碳酸钠不分层、乙酸乙酯与碳酸钠分层;
C.滴加3-4滴2%氢氧化钠溶液,NaOH不足;
D.溴乙烷与氢氧化钠溶液共热,发生水解反应生成NaBr,检验溴离子应在酸性溶液中.
解答 解:A.苯酚与浓溴水反应制备三溴苯酚,三溴苯酚易溶于苯和苯酚,不易分离,故A错误;
B.乙酸与碳酸钠反应生成气体、乙醇与碳酸钠不分层、乙酸乙酯与碳酸钠分层,现象不同,可鉴别,故B正确;
C.滴加3-4滴2%氢氧化钠溶液,NaOH不足,检验-CHO应在碱性溶液中,故C错误;
D.溴乙烷与氢氧化钠溶液共热,发生水解反应生成NaBr,检验溴离子应在酸性溶液中,应先加酸至酸性,再滴加硝酸银溶液检验,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离提纯、有机物的结构与性质、离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
3.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | HCl的电子式: | |
| C. | CH3COOH官能团名称:羟基 | |
| D. | 氨水的电离方程式:NH3•H2O?NH${\;}_{4}^{+}$+OH- |
7.下列关于烃的说法正确的是( )
| A. | 苯和甲苯均能使酸性高锰酸钾溶液褪色 | |
| B. |  与等物质的量的溴反应产物仅有2种 与等物质的量的溴反应产物仅有2种 | |
| C. | 分子式为C8H10且属于芳香烃的同分异构体有3种 | |
| D. | 等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多 |
17.常温下,有pH=1的某溶液中可能含有Na+、Fe2+、Fe3+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下实验:

根据实验结果,下列判断正确的是( )

根据实验结果,下列判断正确的是( )
| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | 不能确定Na+和Cl-是否存在,CO${\;}_{3}^{2-}$一定不存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)≥0.1mol•L-1 |
4.下列物质性质与应用对应关系不正确的是( )
| A. | SO2有漂白性,工业上常用它来漂白纸浆 | |
| B. | 单质硅具有半导体性能,可以制成光电池 | |
| C. | Fe2O3是一种红棕色粉末,常用作红色油漆 | |
| D. | 明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |
1.下列有关说法正确的是( )
| A. | 玻璃钢和钢化玻璃成分不同,但都属于复合材料 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、Cl2都可用浓硫酸干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
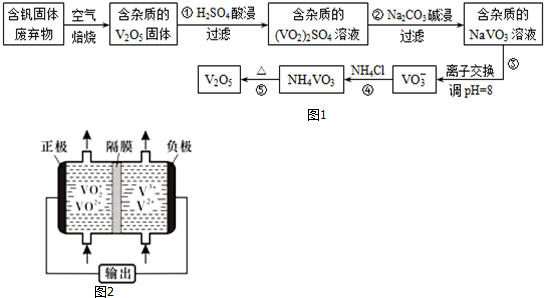
12.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1:
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如下表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.