题目内容
11.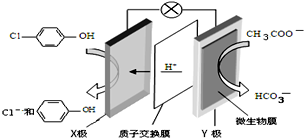 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )| A. | Y极为该电池的负极 | |
| B. | X极的电极反应式为: +H++2e-═ +H++2e-═ +Cl- +Cl- | |
| C. | 可用硝酸酸化的硝酸银溶液验证正极产物 | |
| D. | 每处理1mol对氯酚,消耗8.2g乙酸钠 |
分析 原电池工作时,阳离子向正极移动,则X是正极,正极上发生得电子的还原反应: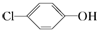 +2e-+H+═
+2e-+H+═ -OH+Cl-,Y为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
-OH+Cl-,Y为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
解答 解:A.由氢离子的定向移动可知X为正极,Y为负极,故A正确;
B.正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,故B正确;
-OH+Cl-,故B正确;
C.正产物中产生氯离子,可用硝酸酸化的硝酸银溶液验证正极产物,故C正确;
D.每处理1mol对氯酚,转移电子2mol,根据CH3COO--8e-+2H2O=2CO2+7H+,消耗1/4mol乙酸钠,质量为21g,故D错误.
故选:D.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
相关题目
1.下列操作会导致所配的溶液浓度偏高的是( )
| A. | 定容时仰视刻度线 | |
| B. | 定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线 | |
| C. | 烧杯中的溶液未冷却至室温就将溶液移到容量瓶中 | |
| D. | 容量瓶洗涤后仍有少量残留 |
19.短周期的元素中,同族元素的原子序数的差值不可能是( )
| A. | 2 | B. | 8 | C. | 16 | D. | 18 |
6.下列说法错误的是( )
| A. | 铍、镁、钙、锶、钡等碱土金属元素,在自然界都以化合态存在 | |
| B. | 从元素周期表知道,现在已经发现了113种原子 | |
| C. | 室温时,0族元素的单质都是气体 | |
| D. | 第三周期的主族元素原子的最高正价数与原子最外层电子数相等 |
3.铅蓄电池放电时的电池反应为PbO2+Pb+H2SO4=2PbSO4+2H2O,下列说法正确的是( )
| A. | Pb是正极 | B. | PbO2得电子,被氧化 | ||
| C. | 负极反应是:Pb-2e-+SO42-=PbSO4 | D. | 电池放电时,溶液酸性增强 |
20.由H2、O2和N2组成的混合气体在同温、同压下与CO的密度相同,则该混合气体中H2、N2和O2的体积比为( )
| A. | 1:1:1 | B. | 2:1:13 | C. | 13:1:2 | D. | 1:16:14 |
16.实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示: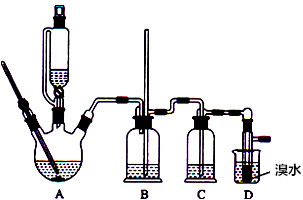
有关数据列表如下:
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)装置B的作用是防止倒吸,判断装置是否堵塞.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(2)装置B的作用是防止倒吸,判断装置是否堵塞.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液.
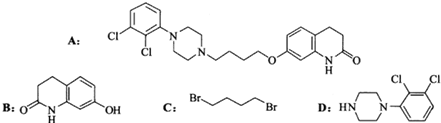
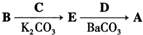
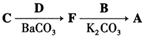
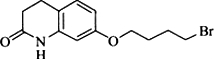 .其含氧官能团有肽键、醚键(写名称).
.其含氧官能团有肽键、醚键(写名称).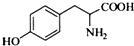 、
、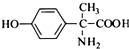 .
.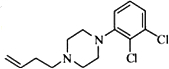 .
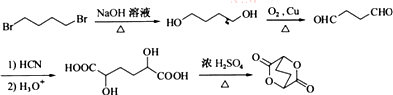
.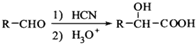 ,写出由C制备化合物
,写出由C制备化合物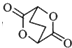 的合成路线流程图(无机试剂任选). (合成路线流程图示例如下:
的合成路线流程图(无机试剂任选). (合成路线流程图示例如下: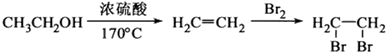 )
) .
.