题目内容
15.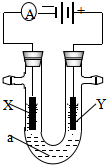 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为2H++2e-=H2↑.在X极附近观察到的实验现象是放出气体,溶液变红.
②Y电极上的电极反应式为2Cl--2e-=Cl2↑.
③要使电解后溶液恢复到电解前的状态,则需加入(或通入)HCl.
(2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是纯铜,电极反应式为Cu2++2e-=Cu.
②Y电极的材料是粗铜,电极反应式为Cu-2e-=Cu2+.(说明:杂质发生的电极反应不必写出)
分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;电解质复原的方法:出什么加什么;
(2)根据电解精炼铜的工作原理知识来回答.
解答 解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
③根据两极上发生的反应,结合电解质复原的方法:出什么加什么,要使电解后溶液恢复到电解前的状态,则需通入HCl气体,故答案为:HCl;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜; Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+.
点评 本题考查学生电解池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
5.下列离方程式书写正确的是( )
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
6.在pH=13的溶液中,下列离子能大量共存的是( )
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Ba2+、NO3-、HCO3- | ||
| C. | Na+、K+、SO42-、SiO32- | D. | Na+、Cu2+、Br -、AlO2- |
3.有一种氢氧燃料电池以30%KOH溶液为电解质溶液,工作时的电极反应如下:2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-,下列说法中错误的是( )
| A. | 电池工作时,电子由负极通过外电路流向正极 | |
| B. | 标准状况下,反应3.36L氢气,转移电子0.2mol | |
| C. | 氢氧燃料电池能量利用率不等同于氢气直接燃烧的能量利用率 | |
| D. | 产物为无污染的水,属于环境友好电池 |
18.现有部分元素的性质或原子结构信息如表,据此回答下列问题:
(1)元素X的基态原子核外共有6种空间运动状态不同的电子,元素X与H元素形成的化合物是当今重要的能源,该化合物的电子式为 .
.
(2)元素Y的价电子排布式为2s22p3,元素Y与元素T相比,电负性较大的是N(用元素符号表示).元素Y的第一电离能>氧的第一电离能(填“>”“=”或“<”)
(3)元素Z与元素T相比,非金属性强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物的酸性Z的比T的酸性强
(4)W的电子排布式为1s22s22p63s23p63d64s2,稳定性比较:W3+>W2+(“>”或“<”),原因是Fe3+最外层为半充满结构.
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.(2)元素Y的价电子排布式为2s22p3,元素Y与元素T相比,电负性较大的是N(用元素符号表示).元素Y的第一电离能>氧的第一电离能(填“>”“=”或“<”)
(3)元素Z与元素T相比,非金属性强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物的酸性Z的比T的酸性强
(4)W的电子排布式为1s22s22p63s23p63d64s2,稳定性比较:W3+>W2+(“>”或“<”),原因是Fe3+最外层为半充满结构.
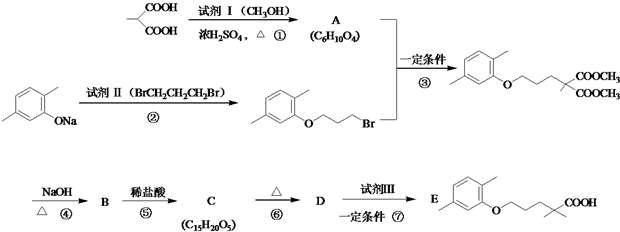
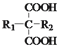 $\stackrel{△}{→}$
$\stackrel{△}{→}$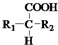 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)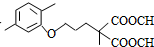 $\stackrel{△}{→}$
$\stackrel{△}{→}$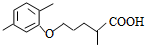 +CO2↑.
+CO2↑.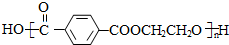 .
.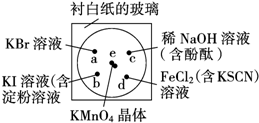 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)