题目内容
10.在NaCl、NaOH、N2、H2S中,只含有离子键的是NaCl,只含有极性键的是H2S,只含有非极性键的是N2,既含有离子键又有极性键的是NaOH.分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,不同非金属形成极性键,同种非金属形成非极性键,以此来解答.
解答 解:NaCl只含离子键,
NaOH含离子键和O-H极性共价键,
N2只含非极性键,
H2S中只含H-S极性键,则
只含有离子键的是NaCl,只含有极性键的是H2S,只含有非极性键的是N2,既含有离子键又有极性键的是NaOH,
故答案为:NaCl;H2S;N2; NaOH.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
19.下列离子方程式与所述事实相符且正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通人过量CO2制Al(OH)3:AlO2-+CO2+H2O═Al(OH)3↓+HCO3- | |
| D. | 向含2molAlCl3的溶液中加入1L 7mol/L的NaOH溶液:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
13.在相同条件下,H2和CO的混合气体VL,完全燃烧时需O2的体积是( )
| A. | 2VL | B. | VL | C. | 0.5VL | D. | 无法计算 |
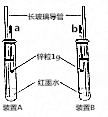 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象. Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.
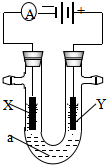 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 和一个-Cl,它的可能的结构有几种( )
和一个-Cl,它的可能的结构有几种( )