题目内容
13.铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.下列有关该电池的说法错误的是( )| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH减小 | |
| D. | 电池充电时,OH-向阳极迁移 |
分析 根据电池总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2可以判断出铁镍蓄电池放电时Fe作负极失电子发生氧化反应生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极得电子发生还原反应,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,充电与放电相反,据此解答.
解答 解:A.根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2可知产物有氢氧化物,则电解液为碱性溶液,放电时Fe失电子发生氧化反应,Fe作负极,故A正确;
B.放电时Fe作负极失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,负极反应为Fe+2OH--2e-=Fe(OH)2,故B正确;
C.充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,因此充电过程中阴极附近溶液的pH会升高,故C错误;
D.电池充电时,阴离子向阳极移动,阳离子向阴极移动,故D正确;
故选C.
点评 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应.

练习册系列答案
相关题目
4.已知A、B、C、D、E五种短周期主族元素,原子序数依次增大,其中A与C、B与D分别同主族,且B原子的最外层电子数等于A与C原子序数之和的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | D、E的气态氢化物的热稳定性:D>E | |
| C. | C可与另外四种元素能够分别形成单原子核阴离子的离子化合物 | |
| D. | A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同 |
8.有机物分子中原子间(或者原子与原子团间)的相互影响会导致其化学性质的不同.下列各项事实不能说明上述观点的是( )
| A. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| B. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯能发生加成反应,而乙烷不能发生加成反应 |
18.在由乙烯和过氧乙酸(CH3COOH)制备环氧乙烷的反应中,同时生成了乙酸,则原子利用率是( )
| A. | 48% | B. | 42% | C. | 26% | D. | 24% |
5.下列反应的化学方程式书写及反应类型判断均正确的是( )
| A. | 甲烷与氯气反应:CH4+Cl2$\stackrel{高温}{→}$CH3Cl+HC1(加成反应) | |
| B. | 乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O$→_{一定条件}^{催化剂}$C3CH2OH(加成反应) | |
| C. | 麦芽糖制葡萄糖:$\stackrel{{C}_{12}{H}_{22}{O}_{11}}{麦芽糖}$+H2O$\stackrel{稀硫酸}{→}$$\stackrel{2{C}_{6}{H}_{12}{O}_{6}}{葡萄糖}$(氧化反应) | |
| D. | 乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+3NH3+2Ag↓+H2O(取代反应) |
2.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L己烷含有分子的数目为0.1NA | |
| D. | 1mol甲基所含的电子数目为9NA |
12.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
(1)已知:CH3OH(g)═HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
请回答下列问题:
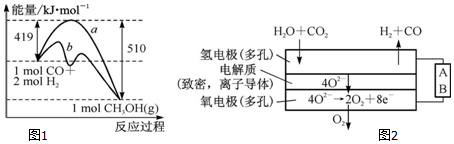
①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为3.2g.
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
(1)已知:CH3OH(g)═HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |

①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
 (1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.