题目内容
1.在160mL未知浓度的稀硫酸中,加入100mL浓度为0.4mol/L的氯化钡溶液,生成白色沉淀,反应后硫酸有剩余,尚需加入48mL浓度为2mol/L的氢氧化钠溶液才能使溶液呈中性.试求:(1)白色沉淀的质量
(2)原硫酸溶液的物质的量浓度.
分析 n(BaCl2)=0.1L×0.4mol/L=0.04mol,n(NaOH)=0.048L×2mol/L=0.096mol,相关反应的离子方程式为Ba2++SO42-=BaSO4↓、H++OH-=H2O,结合反应的离子方程式计算该题.
解答 解:(1)n(BaCl2)=0.1L×0.4mol/L=0.04mol,反应后硫酸有剩余,由反应Ba2++SO42-=BaSO4↓可知,生成n(BaSO4)=n(BaCl2)=0.04mol,
m(BaSO4)=0.04mol×233g/mol=9.32g,
答:白色沉淀的质量为9.32g;
(2)加入48mL浓度为2mol/L的氢氧化钠溶液才能使溶液的pH为7,发生H++OH-=H2O,
n(NaOH)=0.048L×2mol/L=0.096mol,
则n(H2SO4)=$\frac{1}{2}$n(H+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$×0.096mol=0.048mol,
c(H2SO4)=$\frac{0.048mol}{0.16L}$=0.3mol/L,
答:原硫酸溶液的物质的量浓度为0.3mol/L.
点评 本题考查化学方程式的计算,题目难度不大,注意相关反应的离子方程式,可根据方程式计算该题.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
12.下列元素的基态原子中最难失去电子的是( )
| A. | F | B. | O | C. | Ne | D. | He |
9.黄酒又叫老酒,越陈越香,越陈越好,因为黄酒中醇与有机酸反应.该过程中发生的反应为( )
| A. | 取代反应 | B. | 氧化反应 | C. | 加成反应 | D. | 加聚反应 |
16.下列俗名和化学式不吻合的是( )
| A. | 明矾 KAl(SO4)2•12H2O | B. | 重晶石 BaSO4 | ||
| C. | 熟石膏 2CaSO4•H2O | D. | 绿矾 CuSO4•5H2O |
6.工业酒精和用粮食发酵产生的酒精的成分不完全相同.严禁用工业酒精勾兑食用酒,否则会使人双目失明甚至死亡.工业酒精中的有毒成分是( )
| A. | CH3CH2OH | B. | CH3COOC2H5 | C. | CH3OH | D. | CH3COOCH3 |
13.铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.下列有关该电池的说法错误的是( )
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH减小 | |
| D. | 电池充电时,OH-向阳极迁移 |
11.某烃的分子组成是苯环上2个互为对位的碳原子上连接有2个丁基,结构可以表示为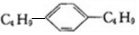 ,符合这一结构的烃有( )
,符合这一结构的烃有( )
 ,符合这一结构的烃有( )
,符合这一结构的烃有( )| A. | 16种 | B. | 12种 | C. | 8种 | D. | 10种 |