题目内容
5.下列叙述正确的是( )| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 丁达尔效应是溶液与胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
分析 A.分散质粒子直径1nm~100nm之间的分散系为胶体;
B.胶体粒子吸附电荷带电;
C.分散系的分类是依据分散质粒子大小;
D.胶体不能透过半透膜.
解答 解:A.分散质粒子直径1nm~100nm之间的分散系为胶体,直径介于1nm~100nm之间的微粒为纯净物时不是分散系,不是胶体,故A错误;
B.胶体的表面积较大,胶体粒子能吸附电荷带电,加电压时会定向移动,故B正确;
C.分散系的分类是依据分散质粒子大小,分散质粒子大小是溶液与胶体的本质区别,故C错误;
D.胶体粒子很小,可以透过滤纸,但是胶体不能透过半透膜,故D错误.
故选B.
点评 本题考查胶体的重要性质和分散系,题目难度不大,侧重对基础知识的巩固,注意胶体与其它分散系的本质区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如图:
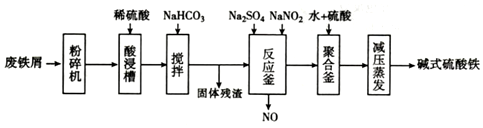
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.
16.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度为3 mol/L |
20.标准状况下,将V L HCl气体溶于0.1L水中,所得溶液密度为ρg.cm-3,则此溶液物质的量浓度为( )
| A. | 100ρV/(36.5V+2240) | B. | 1000ρV/(36.5V+2240) | ||
| C. | ρ V/(36.5V+2240) | D. | (1000+36.5ρV)/( 36.5V+2240) |
10.按照物质的树状分类和交叉分类,HNO3应属于( )
①强酸 ②氧化物 ③含氧酸 ④一元酸 ⑤电解质 ⑥混合物 ⑦无机化合物.
①强酸 ②氧化物 ③含氧酸 ④一元酸 ⑤电解质 ⑥混合物 ⑦无机化合物.
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
17.下列各组离子在指定溶液中能大量共存的是( )
| A. | 酸性溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 滴入酚酞显红色的溶液中:Na+、K+、SiO32-、HCO3- | |
| C. | 滴入石蕊显红色的溶液中:K+、Ca2+、Fe2+、NO3- | |
| D. | 澄清透明溶液中:K+、MnO4-、H3O+、SO42- |
14.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,下列说法正确的是( )
| A. | 2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 | |
| C. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
15.0.25mol Na2SO4中所含的Na+离子数约为( )
| A. | 0.5 | B. | 6.02×1023 | C. | 3.01×1023 | D. | 2 |