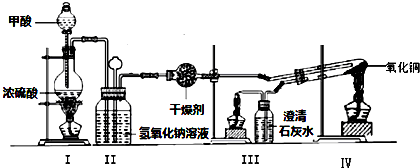
题目内容
1.下列说法不正确的是( )| A. | 常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)=c(Cl-) | |
| B. | NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 0.5 mol/L 的Na2S溶液中:$\frac{1}{2}$ c(Na+)=c(H2S)+c(HS-)+c(S2-)=0.5 mol/L |
分析 A.常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性,溶液中存在电荷守恒和物料守恒分析;
B.NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性NaHSO4与Ba(OH)2按照2:1恰好反应生成硫酸钠、硫酸钡和水;
C.某酸式盐NaHA溶液中一定存在电荷守恒、物料守恒,依据酸式盐是强酸酸式盐或弱酸的酸式盐计算分析;
D.溶液中存在物料守恒,n(Na)=2n(S),硫元素所有存在形式总和等于钠离子浓度的2倍.
解答 解:A.常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性,溶液中存在电荷守恒,c(Cl-)+c(OH-)+c(CH3COO-)=c(H+)+c(Na+),物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),c(CH3COOH)=c(Cl-),故A正确;
B.NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性NaHSO4与Ba(OH)2按照2:1恰好反应生成硫酸钠、硫酸钡和水,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,离子浓度大小为:c(Na+)>c(SO42-)>c(OH-)=c(H+),故B正确;
C.酸式盐若为弱酸的酸式盐,溶液中存在电荷守恒,c(OH-)+2c(A2-)+c(HA-)=c(H+)+c(Na+),物料守恒c(Na+)=c(A2-)+c(HA-)+c(H2A)得到c(OH-)+c(A2-)=c(H+)+c(H2A),若为强酸的酸式盐c(OH-)+2c(A2-)=c(H+)+c(Na+),c(Na+)=c(A2-),则c(OH-)+c(A2-)=c(H+),故C错误;
D.0.5 mol/L 的Na2S溶液中存在物料守恒,n(Na)=2n(S):$\frac{1}{2}$ c(Na+)=c(H2S)+c(HS-)+c(S2-)=0.5 mol/L,故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒计算应用、注意溶液中溶质微粒的存在形式,掌握基础是解题关键,题目难度中等.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案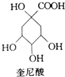 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )| A. | 分子式为C7H12O6 | B. | 不能发生加成反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 1mol奎尼酸最多能消耗6molNaOH |
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
| A. | 去年12月我国向月球发射的“玉兔号”月亮车,体现了我国航天科技的实力,车上安装的太阳能电池帆板的材料是二氧化硅 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 中国食品质量监督局规定,从2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,由此说明添加剂均会严重危害人体健康 | |
| D. | 以煤为燃料的工厂、汽车尾气排放物等容易造成雾霾,治理雾霾最好的办法是研制纳米级口罩,以确保肺癌的发病率降低 |
| A. | 用KMnO4酸性溶液鉴别乙烯和CO2 | |
| B. | 用pH试纸鉴别NaCl溶液与HCl溶液 | |
| C. | 用观察外观颜色的方法区别铜板和铝板 | |
| D. | 用KOH溶液鉴别Na2CO3和KNO3溶液 |
| A. | 从海水中可提取食盐 | B. | 海水蒸馏可得淡水 | ||
| C. | 直接电解海水可得镁 | D. | 从海水中可提取溴 |
| A. | 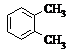 和 和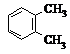 | B. | 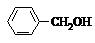 和 和 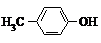 | C. |  和 和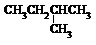 | D. | 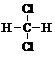 和 和 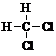 |
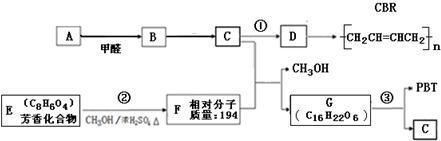
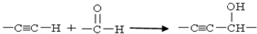
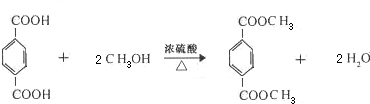 .E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是
.E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是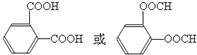 .
.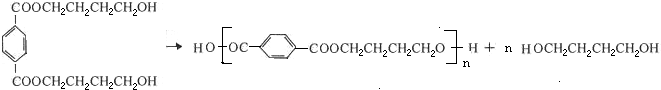 .
.