题目内容
下列离子方程式正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、等体积、等物质的量浓度的NaHCO3和 Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| D、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
考点:离子方程式的书写
专题:
分析:A.HI溶液过量,硝酸根离子、三价铁离子都被还原;
B.二氧化硫过量反应生成亚硫酸氢钠;
C.等物质的量的NaHCO3和 Ba(OH)2反应生成碳酸钡和氢氧化钠和水;
D.亚硝酸根离子在酸性环境下能够被酸性的高锰酸钾氧化生成硝酸根离子.
B.二氧化硫过量反应生成亚硫酸氢钠;
C.等物质的量的NaHCO3和 Ba(OH)2反应生成碳酸钡和氢氧化钠和水;
D.亚硝酸根离子在酸性环境下能够被酸性的高锰酸钾氧化生成硝酸根离子.
解答:
解:A.Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO3-+12H++12I-=Fe2++2I-+5I2+3NO↑+6H2O,故A错误;
B.过量的SO2通入NaOH溶液中,离子方程式:SO2+OH-═HSO3-,故B错误;
C.等物质的量的NaHCO3和 Ba(OH)2反应生成碳酸钡和氢氧化钠和水,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C错误;
D.NaNO2溶液中加入酸性KMnO4溶液,离子方程式:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,故D正确;
故选:D.
B.过量的SO2通入NaOH溶液中,离子方程式:SO2+OH-═HSO3-,故B错误;
C.等物质的量的NaHCO3和 Ba(OH)2反应生成碳酸钡和氢氧化钠和水,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C错误;
D.NaNO2溶液中加入酸性KMnO4溶液,离子方程式:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意反应物用量对反应的影响,选项A、C为易错选项.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
表示0.1mol/L NaHCO3溶液中有关粒子浓度的关系正确的是 ( )
| A、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
选用一种试剂就能把失去标签的CCl4、苯、乙醇三种试剂区分开,则下列不可行的( )
| A、无水硫酸铜 |
| B、溴水 |
| C、水 |
| D、KMnO4溶液 |
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g)+2B(g)?C(g) 反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A、前10 min内反应的平均速率为v(C)=0.050 mol?L-1?min-1 |
| B、保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol |
| C、若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积,则A的转化率减小 |
| D、温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为( )
| A、2.4×10-7mol/L |
| B、0.1×10-7mol/L |
| C、(1×10-14)/(2.4×10-7)mol/L |
| D、无法确定 |


 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2 的反应得到
的反应得到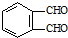 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式: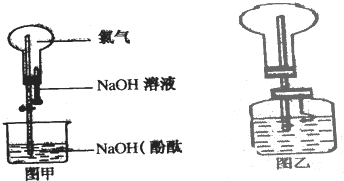 某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测:
某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测:
 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是